
| 实验A | 实验B | |
| 操作 | 在注射器中加入过量镁片(擦去表面氧化膜),吸入15mL饱和NaHCO3溶液. | 在注射器中加入过量镁片(擦去表面氧化膜),吸入15mL蒸馏水. |
| 现象 | 有气体产生,20min后注射器内壁和底部产生大量白色沉淀 | 缓慢产生气体 |

分析 (1)本实验探究Mg与碳酸氢钠的反应,实验A加入碳酸氢钠水溶液,故为了排除其中水的干扰,设置实验B,加入等体积的水,与A对照;
(2)碳酸氢钠为强电解质,溶于水电离出碳酸氢根离子与钠离子,碳酸氢根离子在水中电离和水解;
(3)由实验B知:Mg与水缓慢反应生成氢氧化镁和氢气;
(4)Mg反应生成镁离子,氧化还原反应中,化合价有升有降,则降价的是氢元素,生成氢气;
(5)溶液中存在平衡HCO3-?H++CO32-,加入镁与H+反应,使c(H+)减少,平衡正移,产生CO32-;滴BaCl2溶液,产生白色沉淀;
(6)根据物质白色不溶物可能是Mg(OH)2 或MgCO3或Mg(OH)2 ,MgCO3;
(7)根据生成的二氧化碳的质量计算出碳酸镁的质量,剩余的就是氢氧化镁的质量;
(8)根据分析、计算可知,镁与碳酸氢钠溶液反应生成Mg(OH)2•2MgCO3、碳酸钠和氢气,据此写出反应的化学方程式.
解答 解:(1)本实验探究Mg与碳酸氢钠的反应,实验A加入碳酸氢钠水溶液,故为了排除其中水的干扰,设置实验B,加入等体积的水,与A对照;
故答案为:与实验A做对照,排除水的干扰;
(2)NaHCO3溶于水所发生的变化有:电离:NaHCO3=Na++HCO3-,碳酸氢根离子为碳酸的酸根离子,继续电离和水解:HCO3-?H++CO32-,HCO3-+H2O?H2CO3+OH-;
故答案为:NaHCO3=Na++HCO3-;HCO3-?H++CO32-,HCO3-+H2O?H2CO3+OH-;
(3)Mg与H2O反应方程式为:Mg+2H2O=Mg(OH)2+H2↑;
故答案为:Mg+2H2O=Mg(OH)2+H2↑;
(4)根据实验二的现象,A中生成的气体有氢气,二氧化碳,B中的气体为氢气,Mg参与反应生成镁离子,化合价升高,则还应有化合价降低的元素,为氢元素,降低到0价,生成氢气,实验A和B产生的气体中必然有氢气;
故答案为:H2;
(5)分别取少量实验A和B的上层清液于两支试管中,各加入2滴BaCl2溶液,A中立即产生白色沉淀,该沉淀为碳酸钡,故含有CO32-,原因是:溶液中存在平衡HCO3-?H++CO32-,加入镁与H+反应,使c(H+)减少,平衡正移,产生CO32-;
故答案为:CO32-;溶液中存在平衡HCO3-?H++CO32-,加入镁与H+反应,使c(H+)减少,平衡正移,产生CO32-;
(6)根据物质白色不溶物可能是Mg(OH)2 或MgCO3或Mg(OH)2 •MgCO3;
故答案为:Mg(OH)2 或MgCO3或碱式碳酸镁;
(7)将A中白色沉淀过滤、洗涤后,取0.1mol加入1mol/L盐酸800mL恰好完全反应,n(H+)=0.8mol,产生标况下的CO2气体6.72L,物质的量为:6.72L÷22.4L/mol=0.3mol,说明沉淀中有碳酸根离子0.3mol,0.3mol二氧化碳的生成需要氢离子0.6mol,则剩余0.2mol的氢离子的消耗应为氢氧化镁,含有的氢氧根离子为0.1mol,故沉淀为Mg(OH)2 •3MgCO3;
故答案为:Mg(OH)2 •3MgCO3;
(8)根据以上分析可知,镁与饱和碳酸氢钠溶液反应生成Mg(OH)2•3MgCO3沉淀、CO2、Na2CO3和H2;
故答案为:Na2CO3、H2、CO2、Mg(OH)2•3MgCO3.
点评 本题考查了镁与碳酸氢钠的反应,涉及盐类的水解,物质的性质,实验现象,物质组成的推断等知识点,侧重于对实验的分析和,要求学生基础知识的掌握要扎实,同时灵活分析,题目难度较大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(HCl):将气体通入饱和Na2CO3溶液中 | |
| B. | Cl2(HCl):将气体通入饱和食盐水中 | |
| C. | NO2(NO):将气体通入水中 | |
| D. | CO2(SO2):将气体通入澄清石灰水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气中:CO2、NO、N2、NH3 | |
| B. | 明矾溶液中:H+、Mg2+、Na+、Cl- | |
| C. | 过量铁与稀硝酸反应后的溶液中:H+、Cl-、I-、Na+ | |
| D. | 常温下,水电离出的c(H+)=1×10-12mol/L的溶液中:NH4+、Na+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “天宫二号”使用的碳纤维,是一种新型有机高分子材料 | |
| B. | 施肥时,草木灰不能与铵盐混合使用,是因为它们之间发生反应会降低肥效 | |
| C. | 明矾常用作净水剂,是因为它能够消毒杀菌 | |
| D. | 14C可用于文物年代的鉴定,14C与12C互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 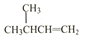 的名称为:2-甲基-3-丁烷 的名称为:2-甲基-3-丁烷 | |
| B. | HOCH2COOH缩聚物的结构简式为: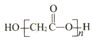 | |
| C. | 甲烷、苯均不能使酸性高锰酸钾溶液褪色,但二者都具有还原性 | |
| D. | 乙酸分子中不含醛基,所以不能与新制的Cu(OH)2悬浊液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com