
【题目】下列有关烯烃的说法中,正确的是
A. 烯烃分子中所有的原子一定在同一平面上
B. 烯烃在适宜的条件下只能发生加成反应不能发生取代反应
C. 分子式是C4H8的烃分子中一定含有碳碳双键
D. 通过石油的催化裂化及裂解可以得到气态烯烃
科目:高中化学 来源: 题型:
【题目】实验室保存下列化学试剂的方法不正确的是( )
A.新制氯水放在棕色试剂瓶中,避光保存
B.液溴密封盛放在棕色瓶中,液面上放一层水
C.少量金属钠保存在四氯化碳中
D.水玻璃保存在带胶塞的玻璃试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应 :2NaClO2 + Cl2 ===2ClO2 + 2NaCl。
下图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。

(1)仪器P的名称是______________________。
(2)写出装置A中烧瓶内发生反应的离子方程式:_____________________。
(3)B装置中所盛试剂是____________________。
(4)F为ClO2收集装置,应选用的装置是______________(填序号),其中与E装置导管相连的导管口是__________(填接口字母)。

(5)若用100 mL 2 mol·L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是________(填序号)。
A.>0.1 mol B.0.1 mol C.<0.1 mol D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各种液体:①苯;② 四氯化碳;③碘化钾溶液;④乙烯;⑤植物油,分别与溴水混合后充分振荡、静置,液体分为两层,原溴水层几乎是无色的是
A.②⑤ B.只有②④
C.①②④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.5L 0.4mol/L的NaClO溶液中缓慢通入0.1mol CO2根据右表提供的数据,下列判断不正确的是
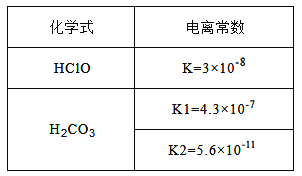
A. 原溶液中:c(ClO-)>c(OH-)>c(H+)
B. 原溶液中c(OH-)=c(H+)+c(HClO)
C. 反应后溶液中c(HClO)>c(HCO3-)>c(ClO-)>c(CO32-)
D. 反应后溶液中c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)+c(ClO-)+c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2SO4是制备K2CO3、KAl(SO4)2等钾盐的原料,可用于玻璃、染料、香料等工业,在医药上可用作缓泻剂,在农业上是主要的无氯钾肥。以下是用氨碱法从明矾石提取硫酸钾工艺流程图。明矾石主要成分为K2SO4Al2(SO4)34Al(OH)3 ,通常含有少量SiO2、Fe2O3等。

回答题:
(1)用28%氨水(密度为0.898g/L)配制4%氨水(密度为0.981g/L)500mL,需28%氨水______mL,配制溶液时,应选用的仪器是______(选填序号)。
(a)20mL量筒 (b)100 mL量筒 (c)500 mL量筒 (d) 500 mL容量瓶
(2)填写下列操作名称:操作Ⅰ_________、操作Ⅱ_________、操作Ⅲ_________。
(3)硅渣主要成分是___________,(写化学式),脱硅后的固体为红泥,可用于_________。
(4)上述流程中可以循环使用的物质X是__________________。
(5)钾氮肥的主要成分是__________,请设计实验检验钾氮肥中(除K+以外)的阳离子:(写出所需试剂、实验步骤和结论)_________________;
(6)为了测定钾氮肥中钾的含量,在试样完全溶于水后,加入足量氯化钡溶液,得到白色沉淀a克,若要计算K2SO4的物质的量,还需要_____________数据,列出计算式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
A. 用A表示的反应速率是0.8 mol·L-1·s-1
B. 在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
C. 分别用B、C、D表示反应的速率,其比值是3∶2∶1
D. 在这2 min内用B和C表示的反应速率的值都是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
⑴ 哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反应速率最大______ (填序号,下同),原因是_____________________________ 。
⑵ 哪一段时段的反应速率最小______,原因是________________________。
⑶ 求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程)_________________ 。
⑷ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A..蒸馏水 B.KNO3溶液 C. NaCl溶液 D.CuSO4溶液
你认为可行的是(填编号) _______________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com