
| A. | 把电能转变为化学能的装置 | |
| B. | 活泼金属做正极,不活泼金属或非金属做负极 | |
| C. | 外电路中电子从负极流向正极 | |
| D. | 正极发生氧化反应 |
分析 A.原电池是将化学能转化为电能的装置;
B.原电池中,电子流出的电极为负极,电子流入的为正极;
C.外电路中,电子从负极沿导线流向正极;
D.正极上得电子发生还原反应.
解答 解:A.原电池反应中能自发的进行氧化还原反应,是将化学能转化为电能的装置,故A错误;
B.原电池中,电子流出的电极为负极,电子流入的电极为正极,电子从活泼金属流向不活泼金属,则活泼金属做负极,不活泼金属为正极,故B错误;
C.外电路中,电子从负极沿导线流向正极,电流从正极沿导线流向负极,故C正确;
D.正极上得电子发生还原反应,负极上失电子发生氧化反应,故D错误;
故选C.
点评 本题考查了原电池原理,根据电子的移动方向、电极反应类型等确定正负极,知道原电池和电解池的区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
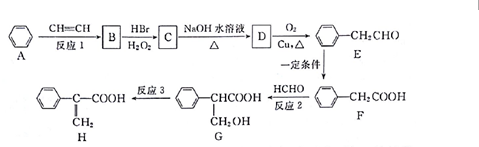
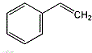 .
. +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr.
+NaBr.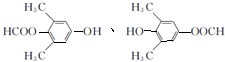 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 HCO3-+OH-,溶液显碱性,促进油脂的水解(结合相关离子方程式解释).
HCO3-+OH-,溶液显碱性,促进油脂的水解(结合相关离子方程式解释).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
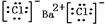 ,⑤的形成过程用电子式表示为
,⑤的形成过程用电子式表示为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑥ | C. | ①② | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com