
”¾ĢāÄæ”æ¹żŃõ»ÆøĘ½ĻĪČ¶Ø£¬²»ČÜÓŚŅŅ“¼£¬Ī¢ČÜÓŚĖ®£¬ČÜÓŚĖį£¬æÉ×÷·ÖĪöŹŌ¼Į”¢Ņ½ÓĆ·ĄøƼĮ”¢Ļū¶¾¼Į”£ŅŌĻĀŹĒŅ»ÖÖÖʱø¹żŃõ»ÆøʵďµŃé·½·Ø”£
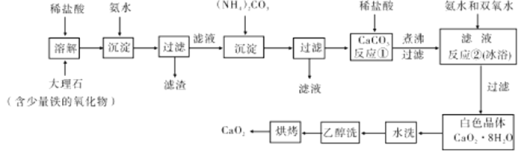
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©“óĄķŹÆ¾¹żČܽā”¢³Įµķ”¢¹żĀĖ”¢ŌŚ³Įµķ”¢ŌŁ¹żĀĖ£¬µĆµ½CaCO3£¬ĘäÄæµÄŹĒ £»¹żĀĖŠčŅŖÓƵ½µÄ²£Į§ŅĒĘ÷Ö÷ŅŖÓŠĀ©¶·”¢ÉÕ±ŗĶ ”£
£Ø2£©·“Ó¦¢ŁµÄ¾ßĢå²Ł×÷×÷ĪŖÖšµĪ¼ÓČėĻ”ŃĪĖį£¬ÖĮČÜŅŗÖŠÉŠ“ęÓŠÉŁĮæ¹ĢĢ唣½«ČÜŅŗÖó·Š£¬³ĆČČ¹żĀĖ”£½«ČÜŅŗÖ󷊵Ä×÷ÓĆŹĒ ”£
£Ø3£©·“Ó¦¢ŚµÄ»Æѧ·½³ĢŹ½ĪŖ £¬øĆ·“Ó¦ŠčŅŖŌŚ±łŌ”ĻĀ½ųŠŠ£¬ŌŅņŹĒ ”£
£Ø4£©°×É«¾§ĢåĖ®Ļ“Ź±£¬ÅŠ¶ĻŹĒ·ńĻ“¾»µÄ·½·ØŹĒ £»Ź¹ÓĆŅŅ×ķĻ“µÓµÄÄæµÄŹĒ ”£
£Ø5£©Öʱø¹żŃõ»ÆøʵÄĮķŅ»ÖÖ·½·ØŹĒ£ŗ½«ŹÆ»ŅŹÆ¶ĶÉÕŗó£®Ö±½Ó¼ÓČĖĖ«ŃõĖ®·“Ó¦£¬¹żĀĖŗóæɵƵ½¹żŃõ»ÆøĘ²śĘ·”£øĆ·ØµÄÓŵćŹĒ¹¤ŅÕ¼ņµ„”¢²Ł×÷¼ņµ„£®ĖłµĆ²śĘ·µÄȱµćŹĒ ”£
£Ø6£©CaO2”¤8H2O¼ÓČČĶŃĖ®µÄ¹ż³ĢÖŠ,Šč²»¶ĻĶØČėŃõĘų£®ÄæµÄŹĒŅÖÖĘ¹żŃõ»ÆøĘ·Ö½ā”£ČōĶØČėµÄŃõĘųÖŠ»ģÓŠ¶žŃõ»ÆĢ¼£¬Ęäŗó¹ūŹĒ £»ŅŃÖŖCaO2ŌŚ350”ęŃøĖŁ·Ö½āÉś³ÉCaOŗĶO2”£ĻĀĶ¼ŹĒŹµŃéŹŅ²ā¶Ø²śĘ·ÖŠCaO2ŗ¬ĮæµÄ×°ÖĆ£Ø¼Š³Ö×°ÖĆŹ”ĀŌ£©”£
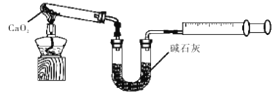
ČōĖłČ”²śĘ·ÖŹĮæĪŖag£¬²āµĆÉś³ÉĘųĢåµÄĢå»żĪŖVmL£ØŅŃ»»Ėć³É±ź×¼×“æö£©£¬Ōņ²śĘ·ÖŠCaO2µÄÖŹĮæ·ÖŹżĪŖ £ØÓĆŗ¬a”¢VµÄŹ½×Ó±ķŹ¾£©”£
”¾“š°ø”æ£Ø1£©³żČ„ŌÓÖŹ£¬µĆµ½“æ¾»µÄĢ¼ĖįøĘ£Ø»ņĢį“æĢ¼ĖįøĘ£©(2·Ö) ²£Į§°ō
£Ø2£©³żČ„ČÜŅŗÖŠČܽāµÄCO2
£Ø3£©CaCl2+H2O2+2NH3H2O+6H2O ØTCaO28H2O”ż+2NH4Cl»ņCaCl2£«2NH3”¤H2O£«H2O2=CaO2£«2NH4Cl£«2H2O(2·Ö) ĪĀ¶Č¹żøߏ±¹żŃõ»ÆĒā·Ö½ā
£Ø4£©Č”ÉŁĮæÄ©“ĪĖ®Ļ“ŅŗÓŚŹŌ¹ÜÖŠ£¬µĪ¼ÓĻ”ĻõĖįĖį»ÆŗóŌŁµĪ¼ÓAgNO3 ČÜŅŗ(2·Ö)
Č„³ż¾§Ģå±ķĆęµÄĖ®·Ö
£Ø5£©“æ¶Č½ĻµĶ
£Ø6£©¶žŃõ»ÆĢ¼Óė¹żŃõ»ÆøĘ·“Ӧɜ³ÉĢ¼ĖįøĘ ![]()
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©“óĄķŹÆ¾¹żČܽā”¢³Įµķ”¢¹żĀĖ”¢ŌŚ³Įµķ”¢ŌŁ¹żĀĖ£¬µĆµ½CaCO3£¬ĘäÄæµÄŹĒ³żČ„ŌÓÖŹ£¬µĆµ½“æ¾»µÄĢ¼ĖįøĘ£»¹żĀĖŠčŅŖÓƵ½µÄ²£Į§ŅĒĘ÷Ö÷ŅŖÓŠĀ©¶·”¢ÉÕ±ŗĶ²£Į§°ō”£
£Ø2£©·“Ó¦¢ŁµÄ¾ßĢå²Ł×÷×÷ĪŖÖšµĪ¼ÓČėĻ”ŃĪĖį²śÉśCO2£¬CO2ÄÜÓė°±Ė®·“Ó¦£¬ĖłŅŌ½«ČÜŅŗÖ󷊵Ä×÷ÓĆŹĒ³żČ„ČÜŅŗÖŠČܽāµÄCO2”£
(3£©øł¾ŻŌ×ÓŹŲŗćæÉÖŖ·“Ó¦¢ŚµÄ»Æѧ·½³ĢŹ½ĪŖCaCl2+H2O2+2NH3H2O+6H2O ØTCaO28H2O”ż+2NH4Cl”£ÓÉÓŚĪĀ¶Č¹żøߏ±¹żŃõ»ÆĒā·Ö½ā£¬ĖłŅŌøĆ·“Ó¦ŠčŅŖŌŚ±łŌ”ĻĀ½ųŠŠ”£
(4£©ČÜŅŗÖŠŗ¬ÓŠĀČĄė×Ó£¬Ōņ°×É«¾§ĢåĖ®Ļ“Ź±ÅŠ¶ĻŹĒ·ńĻ“¾»µÄ·½·ØæÉŅŌĶعż¼ģŃéĀČĄė×Ó£¬Ęä²Ł×÷ŹĒȔɣĮæÄ©“ĪĖ®Ļ“ŅŗÓŚŹŌ¹ÜÖŠ£¬µĪ¼ÓĻ”ĻõĖįĖį»ÆŗóŌŁµĪ¼ÓAgNO3 ČÜŅŗ£»¹żŃõ»ÆøĘ²»ČÜÓŚŅŅ“¼£¬Ī¢ČÜÓŚĖ®£¬Ņņ“ĖŹ¹ÓĆŅŅ“¼Ļ“µÓµÄÄæµÄŹĒČ„³ż¾§Ģå±ķĆęµÄĖ®·Ö”£
£Ø5£©Öʱø¹żŃõ»ÆøʵÄĮķŅ»ÖÖ·½·ØŹĒ£ŗ½«ŹÆ»ŅŹÆ¶ĶÉÕŗó£®Ö±½Ó¼ÓČĖĖ«ŃõĖ®·“Ó¦£¬¹żĀĖŗóæɵƵ½¹żŃõ»ÆøĘ²śĘ·£¬ÓÉÓŚĢ¼ĖįøĘ²»ČÜÓŚĖ®£¬ĖłŅŌĖłµĆ²śĘ·µÄȱµćŹĒ“æ¶Č½ĻµĶ”£
£Ø6£©CO2ŹĒĖįŠŌŃõ»ÆĪļ£¬ĖłŅŌČōĶØČėµÄŃõĘųÖŠ»ģÓŠ¶žŃõ»ÆĢ¼£¬Ęäŗó¹ūŹĒ¶žŃõ»ÆĢ¼Óė¹żŃõ»ÆøĘ·“Ӧɜ³ÉĢ¼ĖįøĘ£»ŃõĘųµÄĪļÖŹµÄĮæŹĒ![]() £¬øł¾Ż·½³ĢŹ½2CaO2£½2CaO+O2”üæÉÖŖCaO2µÄĪļÖŹµÄĮæŹĒ
£¬øł¾Ż·½³ĢŹ½2CaO2£½2CaO+O2”üæÉÖŖCaO2µÄĪļÖŹµÄĮæŹĒ![]() £¬ÖŹĮæŹĒ
£¬ÖŹĮæŹĒ![]() £¬Ņņ“Ė²śĘ·ÖŠCaO2µÄÖŹĮæ·ÖŹżĪŖ
£¬Ņņ“Ė²śĘ·ÖŠCaO2µÄÖŹĮæ·ÖŹżĪŖ![]() ”£
ӣ



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
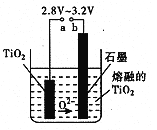
”¾ĢāÄæ”æ21ŹĄ¼ĶŹĒīѵďĄ¼Ķ”£ĻĀĆęŹĒĄūÓĆīŃ°×·Ū(TiO2)Éś²śŗ£ĆąīŃ(Ti)µÄŅ»ÖÖ¹¤ŅÕĮ÷³Ģ£ŗ
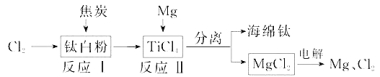
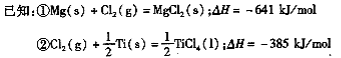
£Ø1£©īŃ°×·ŪŹĒĄūÓĆTiO2+·¢ÉśĖ®½āÉś³ÉīŃĖį(H2TiO3)³Įµķ£¬ŌŁģŃÉÕ³ĮµķÖʵƵĔ£TiO2+·¢ÉśĖ®½āµÄĄė×Ó·½³ĢŹ½ĪŖ £»
£Ø2£©·“Ó¦IŌŚ800~900”ęĻĀ½ųŠŠ£¬»¹Éś³ÉŅ»ÖÖæÉČ¼ŠŌĪŽÉ«ĘųĢ壬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ £»
£Ø3£©·“Ó¦¢ņµÄČČ»Æѧ·½³ĢŹ½ĪŖ £»
£Ø4£©øĆ¹¤ŅÕĮ÷³ĢÖŠ£¬æÉŅŌŃ»·Ź¹ÓƵÄĪļÖŹÓŠ £»
£Ø5£©ŌŚ800 ~1000”ꏱµē½āTiO2Ņ²æÉÖʵĆŗ£ĆąīŃ£¬×°ÖĆČēÓŅĶ¼ĖłŹ¾”£Ķ¼ÖŠbŹĒµēŌ“µÄ ¼«£¬Ņõ¼«µÄµē¼«·“Ó¦Ź½ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗĖÖŠÖŠ×ÓŹżĪŖNµÄR2©£¬ÖŹĮæŹżĪŖA£¬ŌņøĆĄė×ÓµÄŗĖĶāµē×ÓŹżĪŖ£Ø £©
A. A©N©2 B. A©N+2 C. A+N©2 D. A+N+2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚŌŖĖŲÖÜĘŚ±ķµÄĖµ·ØÕżČ·µÄŹĒ£Ø £©
A. 18øöׯŗį“ś±ķ18øö×壬7øöÖ÷×唢8øöø±×å
B. ¶ĢÖÜĘŚ¹²ÓŠ32ÖÖŌŖĖŲ
C. ŌŖĖŲÖÜĘŚ±ķ¹²ÓŠĘßøöŗįŠŠ“ś±ķĘßøöÖÜĘŚ
D. µŚIA×åČ«²æŹĒ½šŹōŌŖĖŲ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚĪļÖŹÓ¦ÓĆŗĶ×é³ÉµÄĖµ·ØÕżČ·µÄŹĒ
A£®¼īŹÆ»ŅæÉÓĆÓŚøÉŌļCl2ŗĶNH3
B£®”°æÉČ¼±ł”±µÄÖ÷ŅŖ³É·ÖŹĒ¼×ĶéŗĶĖ®
C£®CCl4²»æÉÓĆÓŚ¼ų±šäåĖ®ŗĶµāĖ®
D£®SiŗĶSiO2¶¼ÓĆÓŚÖĘŌģ¹āµ¼ĻĖĪ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·ÖÖ¦ĖįæÉÓĆÓŚÉś»ÆŃŠ¾æ”£Ęä½į¹¹¼ņŹ½ČēĶ¼”£ĻĀĮŠ¹ŲÓŚ·ÖÖ¦ĖįµÄŠšŹöÕżČ·µÄŹĒ£Ø £©

A. ·Ö×ÓÖŠŗ¬ÓŠ2ÖÖ¹ŁÄÜĶÅ
B. æÉÓėŅŅ“¼”¢ŅŅĖį·“Ó¦£¬ĒŅ·“Ó¦ĄąŠĶĻąĶ¬
C. 1mol·ÖÖ¦Ėį×ī¶ąæÉÓė3molNaOH·¢ÉśÖŠŗĶ·“Ó¦
D. æÉŹ¹äåµÄĖÄĀČ»ÆĢ¼ČÜŅŗ”¢ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬ĒŅŌĄķĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŌŖĖŲµÄµēøŗŠŌ×ī“óµÄŹĒ£Ø £©
A. Na B. S C. O D. C
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ[»Æѧ”ŖŃ”ŠŽ3£ŗĪļÖŹ½į¹¹ÓėŠŌÖŹ]
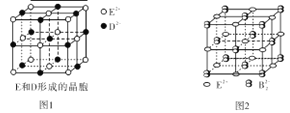
A”¢B”¢C”¢D”¢EŹĒĒ°ĖÄÖÜĘŚŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄĪåÖÖŌŖĖŲ”£AŌŖĖŲŌ×ÓµÄŗĖĶāµē×ÓµČÓŚĘäµē×Ó²ćŹż£»BŌŖĖŲ»łĢ¬Ō×ÓÓŠČżøöÄܼ¶µē×ÓŹżĻąĶ¬£»AŗĶDæÉŠĪ³ÉĮ½ÖÖ³£¼ūŅŗĢ¬»ÆŗĻĪļ¼×”¢ŅŅ£¬ĘäŌ×ÓŹżÖ®±Č·Ö±šĪŖ1:1,2:1£»EŌŖĖŲŌ×ÓµÄK”¢L²ćµē×ÓŹżÖ®ŗĶµČÓŚĘäM”¢N²ćµē×ÓŹżÖ®ŗĶ”£»Ų“šĻĀĮŠĪŹĢā£ØÉę¼°ŌŖĖŲÓĆĻąÓ¦»Æѧ·ūŗűķŹ¾£©£ŗ
£Ø1£©B”¢C”¢DČżÖÖŌŖĖŲÖŠµēøŗŠŌ×ī“óµÄŌŖĖŲĘ仳Ģ¬Ō×ӵĵē×ÓÅŲ¼Ź½ĪŖ ”£
£Ø2£©“¦ÓŚŅ»¶ØæÕ¼äŌĖ¶ÆדĢ¬µÄµē×ÓŌŚŌ×ÓŗĖĶā³öĻÖµÄøÅĀŹĆÜ¶Č·Ö²¼æÉÓĆ ŠĪĻó»ÆĆčŹö”£ŌŚBµÄ»łĢ¬Ō×ÓÖŠ£¬ŗĖĶā“ęŌŚ ¶Ō×ŌŠżĻą·“µÄµē×Ó”£
£Ø3£©ÓÉEŗĶDŠĪ³ÉµÄ¾§°ūČēĶ¼1ĖłŹ¾£¬¾§ĢåÖŠE2£«ÖÜĪ§µČ¾ąĒŅ×ī½üµÄE2£«ÓŠ øö£»EDµÄŃęÉ«·“Ó¦ĪŖשŗģÉ«£¬Šķ¶ą½šŹō»ņĖüĆĒµÄ»ÆŗĻĪļ¶¼æÉŅŌ·¢ÉśŃęÉ«·“Ó¦£¬ŃęÉ«·“Ó¦µÄŌĄķŹĒ ”£EŗĶBæÉŠĪ³ÉµÄ¾§ĢåµÄ¾§°ū½į¹¹ÓėNaCl¾§ĢåµÄĻąĖĘ£ØČēĶ¼2ĖłŹ¾£©£¬µ«øĆ¾§ĢåÖŠŗ¬ÓŠµÄŃĘĮåŠĪB22£µÄ“ęŌŚ£¬Ź¹¾§°ūŃŲŅ»øö·½ĻņĄ³¤”£¾§ĢåÖŠE2+µÄÅäĪ»ŹżĪŖ_______________£»øĆ»ÆŗĻĪļµÄ»ÆѧŹ½ĪŖ ”£
£Ø4£©ÓĆøßÄÜÉäĻßÕÕÉäŅŗĢ¬»ÆŗĻĪļŅŅŹ±£¬Ņ»øöŅŅ·Ö×ÓÄÜŹĶ·Å³öŅ»øöµē×Ó£¬Ķ¬Ź±²śÉśŅ»ÖÖŃōĄė×Ó”£
¢ŁŹĶ·Å³öĄ“µÄµē×ÓæÉŅŌ±»ČōøÉŅŅ·Ö×ÓŠĪ³ÉµÄ”°Ķų”±²¶»ń£¬ŅŅ·Ö×Ó¼äÄÜŠĪ³É”°Ķų”±µÄŌŅņŹĒ ”£
¢ŚÓÉŅŅ·Ö×ÓŹĶ·Å³öµē×ÓŹ±²śÉśµÄŅ»ÖÖŃōĄė×Ó¾ßÓŠ½ĻĒæµÄŃõ»ÆŠŌ£¬ŹŌŠ“³öøĆŃōĄė×ÓÓėSO2µÄĖ®ČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æI”¢Ä³Ń§ÉśÓĆ0.2000 mol”¤L£1µÄ±ź×¼NaOHČÜŅŗµĪ¶ØĪ“ÖŖÅØ¶ČµÄŃĪĖį£¬Ęä²Ł×÷æÉ·ÖĪŖČēĻĀ¼ø²½£ŗ
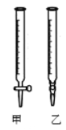
¢ŁÓĆÕōĮóĖ®Ļ“µÓ¼īŹ½µĪ¶Ø¹Ü£¬²¢×¢ČėNaOHČÜŅŗÖĮ”°0”±æĢ¶ČĻßŅŌÉĻ
¢Ś¹Ģ¶ØŗƵĪ¶Ø¹Ü²¢Ź¹µĪ¶Ø¹Ü¼ā×ģ³äĀśŅŗĢå
¢Ūµ÷½ŚŅŗĆęÖĮ”°0”±»ņ”°0”±æĢ¶ČĻßÉŌĻĀ£¬²¢¼ĒĻĀ¶ĮŹż
¢ÜĮæČ”20.00mL“ż²āŅŗ×¢Čė½ą¾»µÄ׶ŠĪĘæÖŠ£¬²¢¼ÓČė3µĪ·ÓĢŖČÜŅŗ
¢ŻÓƱź×¼ŅŗµĪ¶ØÖĮÖÕµć£¬¼ĒĻĀµĪ¶Ø¹ÜŅŗĆę¶ĮŹż
Ēė»Ų“š£ŗ
£Ø1£©ŅŌÉĻ²½ÖčÓŠ“ķĪóµÄŹĒ£ØĢī±ąŗÅ£© ”£
£Ø2£©ÓƱź×¼NaOHČÜŅŗµĪ¶ØŹ±£¬Ó¦½«±ź×¼NaOHČÜŅŗ×¢Čė______ÖŠ”££Ø“ÓĶ¼ÖŠŃ”Ģī”°¼×”±»ņ”°ŅŅ”±£©
£Ø3£©ĻĀĮŠ²Ł×÷»įŅżĘšŹµŃé½į¹ūĘ«“óµÄŹĒ£ŗ______£ØĢī±ąŗÅ£©
A£®ŌŚ×¶ŠĪĘæ×°ŅŗĒ°£¬ĮōÓŠÉŁĮæÕōĮóĖ®
B£®µĪ¶ØĒ°£¬µĪ¶Ø¹Ü¼ā×ģÓŠĘųÅŻ£¬µĪ¶ØŗóĪŽĘųÅŻ
C£®×¶ŠĪĘæĻČÓĆÕōĮóĖ®Ļ“µÓŗó£¬Ī“ÓĆ“ż²āŅŗČóĻ“
D£®ÓĆĖįŹ½µĪ¶Ø¹ÜĮæČ”ŅŗĢåŹ±£¬ŹĶ·ÅŅŗĢåĒ°µĪ¶Ø¹ÜĒ°¶ĖÓŠĘųÅŻ£¬Ö®ŗóĻūŹ§
£Ø4£©µĪ¶ØŹ±£¬×óŹÖæŲÖʵĪ¶Ø¹Ü£¬ÓŅŹÖŅ”¶Æ׶ŠĪĘ棬ŃŪ¾¦×¢ŹÓ ”£ÅŠ¶Ļµ½“ļµĪ¶ØÖÕµćµÄĻÖĻóŹĒ£ŗ׶ŠĪĘæÖŠČÜŅŗ ”£
£Ø5£©ŅŌĻĀŹĒŹµŃ鏿¾Ż¼ĒĀ¼±ķ
µĪ¶Ø“ĪŹż | ŃĪĖįĢå»żmL | NaOHČÜŅŗĢå»ż¶ĮŹż£ØmL£© | |
µĪ¶ØĒ° | µĪ¶Øŗó | ||
1 | 20.00 | 0.00 | 21.30 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.32 |
Ķعż¼ĘĖćæÉµĆ£¬øĆŃĪĖįÅضČĪŖ£ŗ______ molL-1£Ø¼ĘĖć½į¹ū±£Įō4Ī»Š”Źż£©
II”¢ĄūÓĆ¼ä½ÓĖį¼īµĪ¶Ø·Øæɲā¶ØBa2£«µÄŗ¬Į棬ŹµŃé·ÖĮ½²½½ųŠŠ”£
ŅŃÖŖ£ŗ2CrO42££«2H£«£½Cr2O72££«H2O Ba2£«£«CrO42££½BaCrO4”ż
²½Öč1£ŗŅĘČ”x mLŅ»¶ØÅØ¶ČµÄNa2CrO4ČÜŅŗӌ׶ŠĪĘæÖŠ£¬¼ÓČėĖį¼īÖøŹ¾¼Į£¬ÓĆb mol”¤L£1ŃĪĖį±ź×¼ŅŗµĪ¶ØÖĮÖÕµć£¬²āµĆµĪ¼ÓŃĪĖįĢå»żĪŖV0 mL”£
²½Öč2£ŗŅĘČ”y mL BaCl2ČÜŅŗӌ׶ŠĪĘæÖŠ£¬¼ÓČėx mLÓė²½Öč:1ĻąĶ¬ÅØ¶ČµÄNa2CrO4ČÜŅŗ£¬“żBa2£«ĶźČ«³Įµķŗó£¬ŌŁ¼ÓČėĖį¼īÖøŹ¾¼Į£¬ÓĆb mol”¤L£1ŃĪĖį±ź×¼ŅŗµĪ¶ØÖĮÖÕµć£¬²āµĆµĪ¼ÓŃĪĖįµÄĢå»żĪŖV1 mL”£
ŌņBaCl2ČÜŅŗÅضČĪŖ______________________ mol”¤L£1”£Čō²½Öč2ÖŠµĪ¼ÓŃĪĖįŹ±ÓŠÉŁĮæ“ż²āŅŗ½¦³ö£¬ŌņBa2£«ÅØ¶ČµÄ²āĮæÖµ½«___________£ØĢī”°Ę«“ó”±»ņ”°Ę«Š””±£©”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com