
| A. | 由于非金属性Y>R,所以X、Y组成化合物的沸点高于X、R组成的化合物 | |
| B. | Y和其他四种元素均可形成至少两种的二元化合物 | |
| C. | RY2能与Y、Z形成的一种化合物反应生成Y2 | |
| D. | Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
分析 X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,Y处于第二周期,R处于第三周期,可组成共价化合物RY2,则Y为氧元素,R为硫元素,RY2为SO2,W的原子序数大于硫元素,故W为Cl元素,Y和Z最外层电子数之和与W的最外层电子数相同,则Z的最外层电子数为7-6=1,处于第ⅠA族,原子序数大于氧元素,故Z为Na元素,25℃时0.1mol•L-1X和W形成化合物的水溶液pH为1,属于强酸,则X为氢元素.
解答 解:X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,Y处于第二周期,R处于第三周期,可组成共价化合物RY2,则Y为氧元素,R为硫元素,RY2为SO2,W的原子序数大于硫元素,故W为Cl元素,Y和Z最外层电子数之和与W的最外层电子数相同,则Z的最外层电子数为7-6=1,处于第ⅠA族,原子序数大于氧元素,故Z为Na元素,25℃时0.1mol•L-1X和W形成化合物的水溶液pH为1,属于强酸,则X为氢元素,
A.X与Y组成化合物为H2O、H2O2,X与R组成的化合物H2S,H2O、H2O2分子间存在氢键,沸点高于硫化氢,与非金属性无关,故A错误;
B.氧元素与氢元素可以形成H2O、H2O2,与钠元素可以形成Na2O、Na2O2,与硫元素可以形成SO2、SO3,与氯元素可以形成ClO2、Cl2O7等,故B正确;
C.Z与Y可以形成Na2O、Na2O2,Na2O与SO2反应得到Na2SO3,Na2O2具有强氧化性,能与SO2反应生成Na2SO4,没有O2生成,故C错误;
D.Y、Z、W三种元素组成的化合物有NaClO、NaClO4等,NaClO溶液中次氯酸根水解,溶液显碱性,而NaClO4溶液呈中性,故D错误.
故选:B.
点评 本题考查位置结构性质关系应用,侧重对元素化合物知识的考查,推断元素是解题的关键,“Y、R元素的位置及二者形成的共价化合物RY2”是推断的突破口.


科目:高中化学 来源: 题型:选择题
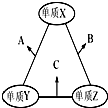 X、Y、Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法不正确的是( )
X、Y、Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法不正确的是( )| A. | X元素位于ⅥA族 | B. | A难溶于B中 | ||
| C. | A和C不可能发生氧化还原反应 | D. | B的沸点高于C的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z | ||
| X | W |
| A. | 原子半径:X<Y<Z | |
| B. | 气态氢化物的稳定性:X>Z | |
| C. | 最高价氧化物对应水化物的酸性:Y>W | |
| D. | Z、W均可与Mg形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2 SO4、NH4NO3、有机微粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霾天气的主要原因之一,回答下列问题:
近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2 SO4、NH4NO3、有机微粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霾天气的主要原因之一,回答下列问题: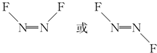 ,1molN2F2分子中所含σ键的数目是3NA.
,1molN2F2分子中所含σ键的数目是3NA.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 根据原子核外电子排布的特点,Zn在周期表中属于ds区元素 | |
| B. | P4和CH4都是正四面体形分子且键角都为109°28′ | |
| C. | NH3分子中N原子和H2O分子中O原子的杂化类型不相同 | |
| D. | 原子间只通过共价键而形成的三维网状结构的晶体一定具有高的熔、沸点及硬度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
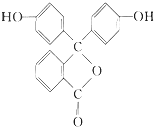
| A. | 酚酞具有弱酸性,且属于芳香烃 | |
| B. | 酚酞的分子式为C19H12O4 | |
| C. | 1mol酚酞最多与2molNaOH发生反应 | |
| D. | 酚酞在碱性条件下能够发生水解反应,呈现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子数≤10 的烷烃,其一氯代物没有同分异构体的烷烃共有3种 | |
| B. | 烯烃、炔烃、芳香烃都能与溴水反应而使其褪色 | |
| C. | 等质量的CH≡CH和C6H6完全燃烧时消耗等物质的量的氧气 | |
| D. | 分子式为C6H12与C3H6的两种烃一定互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com