
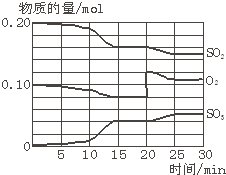
| 1.2mol |
| 2mol |
| 0.16mol |
| 8L |
| 0.08mol |
| 8L |
| 0.04mol |
| 8L |
| 0.0052 |
| 0.02 2��0.01 |
| 25 |
| 4 |
| (2.00) 2 |
| (0.06)2��(0.4) |


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ�� | ��Ӧ�¶�/�� | Na2S2O3��Һ | ϡH2SO4 | H2O | ||
| V/mL | c/��mol?L-1�� | V/mL | c/��mol?L-1�� | V/mL | ||
| A | 10 | 5 | 0.1 | 5 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 5 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| A��H2 |
| B��O2 |
| C��Cl2 |
| D��CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c(H2SO3) |
| c(HSO3-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ǰ2s��N2O4��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.01mol/��L?s�� |
| B����2sʱ��ϵ�ڵ�ѹǿΪ��ʼʱ��1.1�� |
| C����ƽ��ʱ��ϵ�ں�N2O4 0.25mol |
| D��ƽ��ʱ��N2O4��ת����Ϊ40% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������Ȼ�̼������ɫ��֤��ԭ��Һ�д���I- |
| B���������������ɫ��������Һһ������������Һ |
| C����������������������ܹ���ˮ��Ӧ������ |
| D������������ᣬ���ḯʴ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
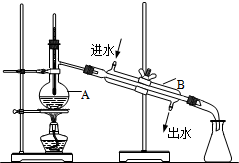 ��ͼΪʵ������ȡ����ˮ��װ��ʾ��ͼ������ͼʾ�ش��������⣮
��ͼΪʵ������ȡ����ˮ��װ��ʾ��ͼ������ͼʾ�ش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | ���� | ���� | |
| A | �μ�Ba��NO3��2 | ���ɰ�ɫ���� | ԭ��Һ����SO42- |
| B | �μ�Ũ������Һ | ������ɫ��ζ���壬������ͨ�뵽����ʯ��ˮ�У������ | ԭ��Һ����CO32- |
| C | �μ���ˮ��CCl4�������� | �²���Һ����ɫ | ԭ��Һ����I- |
| D | ͨ�����������̼���� | ������ɫ��״���� | ԭ��Һ����AlO2- |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������Na2CO3��NaHCO3�ֱ���������ϡ���ᷴӦ��NaHCO3������CO2�� |
| B����������Na2CO3��NaHCO3�ֱ���������ͬŨ�����ᷴӦ��NaHCO3���ĵ������ |
| C����NaHCO3��Һ�е���Ba��OH��2��Һ��������Na2CO3��Һ�м���Ba��OH��2��Һ���ְ�ɫ���� |
| D��Na2CO3��NaHCO3���������ᷴӦ������������������Һ��Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com