
【题目】25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH的变化如图所示{δ(X)=[c(X)/c(H2CO3)+c(HCO3-)+c(CO32-)]×100%}。
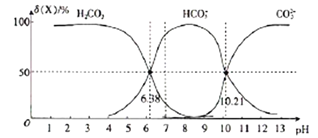
下列说法错误的是
A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38
B. pH=13时,c(Na+)十c(H+)=c(OH-)+2c(CO32-)
C. 25℃时,反应CO32-+H2O![]() HCO3-+OH-的平衡常数对数值1gK=-3.79
HCO3-+OH-的平衡常数对数值1gK=-3.79
D. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-)
【答案】B
【解析】A.由图像可知,pH=6.38时,c(H+)=10-6.38mol/L,c(H2CO3)= c(HCO3-) ,所以,H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38,A正确;B. pH=13时,由电荷守恒可知,c(Na+)十c(H+)=c(OH-)+ c(HCO3-)+2c(CO32-),B不正确;C. 由图可知,pH=10.21时,c(H+)=10-10.21mol/L,c(CO32-)= c(HCO3-) ,所以K2(H2CO3)= 10-10.21,因此,25℃时,反应CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=![]() =10-3.79,其对数值1gK=-3.79,C正确;D. 由图中信息可知,pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-),D正确。本题选B。
=10-3.79,其对数值1gK=-3.79,C正确;D. 由图中信息可知,pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-),D正确。本题选B。


科目:高中化学 来源: 题型:
【题目】我校环保兴趣小组在处理污水样品时,需用2mol·L-1的盐酸配制成250mL 0.1mol·L-1的盐酸溶液。
(1)计算所需2mol·L-1的盐酸的体积是_______________。
(2)在下图所示仪器中,配制上述溶液不需要的是_____________(填相应仪器的序号); 除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________________。

(3)在容量瓶的使用方法中,下列操作正确的是_________________。
A、使用容量瓶前检查它是否漏水
B、容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C、配制溶液时,将量筒量取好的盐酸直接倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(4)配制时其他操作均正确,若定容时俯视刻度线,所配溶液的物质的量浓度______。(填“偏高”;“ 偏低”“ 无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
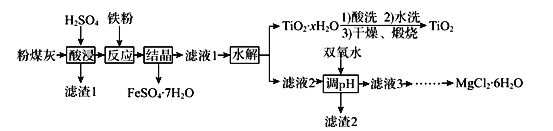
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]= 5.61×10-12
③滤液1中仍有Fe2+剩余
请回答下列问题:
(1)为了提高粉煤灰浸出速率,在“酸浸”时可采取的措施有_______________________
(2)“水解”反应的离子方程式为______________________________________。怎样判断TiO2xH2O沉淀已经洗涤干净____________________________________________。
(3)加入双氧水调节溶液pH时离子方程式为_______________________________________。滤渣2成分为________________。为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”为________。(保留两位有效数字)
(4)滤液3在蒸发结晶制备MgCl26H2O应注意_____________________________________。
(5)“结晶”需控制在70℃左右,温度过高的后果会导致的后果为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、硫、氮的化合物在工业上用途非常广泛。
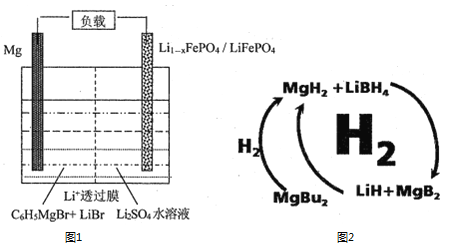
(1)一种镁—锂双离子二次电池的装置如图1所示。
①放电时,Mg电极为_____(填“正极”或“负极”)。
②充电时,Li+迁移至_____________(填“阳极区”或“阴极区”)。
(2)纳米MgH2和LiBH4组成的体系如图2所示,400℃以上受热放氢时发生反应的化学方程式为_____________________________________________。
(3)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:
2NO(g)+4H2(g)+O2(g)==N2(g)+4H2O(g) △H =-1143kJ·mol-1
2H2(g)+ O2(g)==2H2O(g) △H =-484kJ·mol-1
则2NO(g)+2H2(g)==N2(g)+2H2O(g) △H =____kJ·mol-1
(4)在一定条件下,反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
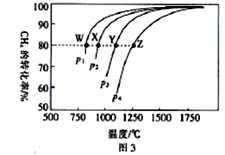
①图中p1、p2、p3、p4代表不同压强,压强最大的是_______。该反应的△H___(填“>”“<”“=”下同)0。
②压强为p4时,在Y点:v(正)__________v(逆)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道:“染色”馒头中添加柠檬黄铬酸铅(PbCrO4)会使人体致癌,已被明文禁用。已知铅元素(Pb)化合价为+2,则铬元素(Cr)的化合价为( )
A.+5B.+6C.+7D.+8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的分类法有交叉分类法、树状分类法等。无机化合物可根据其组成和性质进行分类:
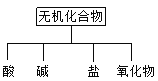
(1)上图所示的物质分类方法名称是_______________________。
(2)以Na、H、O、N、C中两种或三种元素组成合适的物质,分别填在下表①④⑦处。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ① _________②HNO3 | ③NH3H2O ④________ | ⑤Na2CO3 ⑥NaNO3 ⑦_______ | ⑧CO2 ⑨Na2O2 |
(3)在②③⑤⑥⑧⑨六种物质中,属于非电解质的是______________(填序号)。
(4)过量⑧通入④中发生反应的离子方程式为:______________________________________________。⑧与⑨反应的化学方程式为:______________________________。
(5)15.9g⑤溶于水配制成250mL溶液,CO32-的粒子数为__________,Na+的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把18.0mol/L的浓硫酸稀释成1.2mol/L的稀硫酸250mL。
(1)1.2mol/L的稀硫酸的含义是__________(选填字母)。
A.1L水中含有1.2mol H2SO4
B.1L溶液中含有1.2mol H+
C.将117.6g硫酸溶于1L水所配成的溶液
D.从100mL该溶液中取出10mL,剩余溶液的物质的量浓度仍为1.2mol/L
(2)请在下列操作步骤中填写有关的空格:
①用量筒量取_________mL的18.0mol/L的浓硫酸;
②将_______________沿烧杯内壁慢慢注入盛有少量____________的烧杯中;
③将已冷却至室温的硫酸溶液沿玻璃棒注入_________mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线1~2cm处;
⑥改用___________________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(3)由于操作不当,会引起实验误差。下列情况对所配制的H2SO4溶液的物质的量浓度有何影响?(用“偏高”、“偏低”、“无影响”填空)。
①容量瓶用蒸馏水洗涤后残留有少量的水_____________;
②定容时,某同学观察液面的情况如图所示_____________;

③摇匀后,发现溶液的液面低于刻度线,又加水至刻度线____________。
(4)某同学取配制的1.2mol/L的稀硫酸100mL,向其中加入足量的锌粒,产生的H2在标准状况下的体积为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com