
(6分)工业上用NH3、氧气和水作原料,合成化肥硝酸铵100 t。
(1)需要NH3 吨,需要氧气 吨。
(2)若NH3制NO转化率为96%,NO制HNO3转化率为92%,需要NH3 吨(保留两位小数)。
【解析】(1)工业生成硝酸铵的反应式为NH3+HNO3=NH4NO3,硝酸铵的物质的量是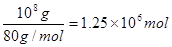 ,所以根据原子守恒可知需要氨气的物质的量是
,所以根据原子守恒可知需要氨气的物质的量是 ,其质量是
,其质量是 ,即为42.5吨。其中一半的氨气用来生产硝酸,另一半用来生产硝酸铵。生产硝酸的反应为4NH3+5O2
,即为42.5吨。其中一半的氨气用来生产硝酸,另一半用来生产硝酸铵。生产硝酸的反应为4NH3+5O2 4NO+6H2O、4NO+3O2+2H2O=4HNO3。即NH3+O2=HNO3+H2O,所以需要氧气的物质的量是
4NO+6H2O、4NO+3O2+2H2O=4HNO3。即NH3+O2=HNO3+H2O,所以需要氧气的物质的量是 ,其质量是
,其质量是 ×32g/mol=80×106g,即质量是80吨。
×32g/mol=80×106g,即质量是80吨。
(2)根据(1)的分析可知生产硝酸的理论上需要氨气是21.25吨,所以根据有关转化率可计算,生产硝酸实际需要氨气是 ,所以最终需要的氨气是24.06t+21.25t=45.31t。
,所以最终需要的氨气是24.06t+21.25t=45.31t。
科目:高中化学 来源:黑龙江省大庆铁人中学2011-2012学年高一下学期第一阶段考试化学试题 题型:038
工业上用NH3、氧气和水作原料,合成化肥硝酸铵100 t.
(1)需要NH3________吨,需要氧气________吨.
(2)若NH3制NO转化率为96%,NO制HNO3转化率为92%,需要NH3________吨(保留两位小数).
查看答案和解析>>
科目:高中化学 来源:非常讲解·教材全解全析 高中化学 必修1 (山东版) 山东版 题型:038
工业上用NH3、空气和水作原料,合成化肥硝酸铵.
(1)若要制100 t硝酸铵,需NH3多少吨?空气中的氧气多少吨?水多少吨?
(2)若NH3制NO的转化率为96%,NO转化为HNO3的转化率为92%,生产100 t硝酸铵需NH3多少吨?
查看答案和解析>>
科目:高中化学 来源:2011-2012年黑龙江大庆铁人中学高一下学期第一次阶段检测化学试卷(带解析) 题型:计算题
(6分)工业上用NH3、氧气和水作原料,合成化肥硝酸铵100 t。
(1)需要NH3 吨,需要氧气 吨。
(2)若NH3制NO转化率为96%,NO制HNO3转化率为92%,需要NH3 吨(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)工业上用NH3、氧气和水作原料,合成化肥硝酸铵100 t。
(1)需要NH3 吨,需要氧气 吨。
(2)若NH3制NO转化率为96%,NO制HNO3转化率为92%,需要NH3 吨(保留两位小数)。
【解析】(1)工业生成硝酸铵的反应式为NH3+HNO3=NH4NO3,硝酸铵的物质的量是![]() ,所以根据原子守恒可知需要氨气的物质的量是
,所以根据原子守恒可知需要氨气的物质的量是![]() ,其质量是
,其质量是![]() ,即为42.5吨。其中一半的氨气用来生产硝酸,另一半用来生产硝酸铵。生产硝酸的反应为4NH3+5O2
,即为42.5吨。其中一半的氨气用来生产硝酸,另一半用来生产硝酸铵。生产硝酸的反应为4NH3+5O24NO+6H2O、4NO+3O2+2H2O=4HNO3。即NH3+O2=HNO3+H2O,所以需要氧气的物质的量是
,其质量是
×32g/mol=80×106g,即质量是80吨。
(2)根据(1)的分析可知生产硝酸的理论上需要氨气是21.25吨,所以根据有关转化率可计算,生产硝酸实际需要氨气是![]() ,所以最终需要的氨气是24.06t+21.25t=45.31t。
,所以最终需要的氨气是24.06t+21.25t=45.31t。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com