
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为14。Z是短周期主族元素中原子半径最大的元素,Z与X原子的最外层电子数相同,Y与W同主族。下列说法正确的是( )
A.X与Y只能形成一种化合物
B.原子半径:r(Y)<r(W)<r(Z)
C.W的简单气态氢化物的热稳定性比Y的强
D.Z的最高价氧化物对应的水化物是酸
【答案】B
【解析】
短周期主族元素X、Y、Z、W的原子序数依次增大;Z是短周期主族元素中原子半径最大的元素,则Z是Na元素;Z与X原子的最外层电子数相同,则Z与X属于同主族,最外层均为1个电子,Y与W同主族,Y与W最外层电子数相同,由X、Y、Z、W原子的最外层电子数之和为14,则Y最外层电子数= ![]() =6,Y原子序数小于W,则Y是O元素、W是S元素,X为H元素或Li元素,再结合题目分析解答.
=6,Y原子序数小于W,则Y是O元素、W是S元素,X为H元素或Li元素,再结合题目分析解答.
A.若X为H元素,Y为O元素,形成H2O和H2O2二种化合物,故A错误;
B.Y是O元素,Z为Na元素,W是S元素,根据电子层越多,半径越大,O元素只有两层,半径最小,Na、S电子层均为三层,属于同周期元素,从左到右,半径依次减小,Na的原子序数小于S,原子半径 r(Na)>r(S),因而原子半径:r(O)<r(S)<r(Na),故B正确。
C.Y是O元素、W是S元素,属于同主族元素,从上往下,非金属性减弱,非金属性O>S,非金属性越强,气态氢化物的热稳定性越强,W的简单气态氢化物的热稳定性比Y的弱,故C错误;
D.Z是Na元素,其最高价氧化物的水化物是NaOH,为强碱,故D错误;
答案为B。


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.红褐色固体![]() 全部溶于氢碘酸:
全部溶于氢碘酸:![]()
B.水杨酸溶于![]() 溶液中:
溶液中:![]()
C.将等浓度的![]() 溶液与
溶液与![]() 液按体积比2:3混合:
液按体积比2:3混合:![]()
D.洁厕灵(含![]() )与84消毒液混合后产生氯气:
)与84消毒液混合后产生氯气:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:溴苯的熔点为30.8℃,沸点156℃。实验室用苯和液溴制取溴苯的装置如图:
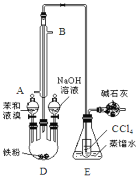
(1)冷凝管的作用___。
(2)E中小试管内CCl4作用___。
(3)用实验证明制取溴苯的反应是取代反应还需添加的试剂是___。
(4)写出图中装有碱石灰的仪器的名称___。
(5)苯与溴还可能发生副反应生成对二溴苯(沸点220℃)和邻二溴苯(沸点224℃),在实验得到的溴苯中还含有二溴苯,可通过___(填分离方法)提纯得到溴苯,写出生成对二溴苯的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧生成SO2气体,放出的热量一样多
B.由C(石墨)=C(金刚石) ΔH=+1.90kJ·mol-1可知,金刚石比石墨稳定
C.2CO(g)+O2(g)=2CO2(g) ΔH<0,则56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
D.已知:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1,则相同条件下,在密闭容器中,1molN2和3molH2混合充分反应后放出92.4kJ的热量
2NH3(g) ΔH=-92.4kJ·mol-1,则相同条件下,在密闭容器中,1molN2和3molH2混合充分反应后放出92.4kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为__、__,制得等量H2所需能量较少的是__。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=__%,反应平衡常数K=__。
②在620K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率α2__α1,该反应的ΔH__0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是__(填标号)
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L己烷中含有分子数目为NA
B. 1mol/LNaOH溶液中含有Na+数目为NA
C. 7.8gNa2O2中含有的共价键数目为0.1NA
D. 将0.5molN2O4充入密闭容器中充分反应转化成NO2的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功实现甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳香烃和氢气等化产品,为天然气化工开发了一条革命性技术。以甲烷为原料合成部分化工产品流程如图(部分反应条件已略去):

(1)E中官能团的名称为___,C物质的结构简式为___。
(2)上述③~⑥转化反应中,属于取代反应的有___(用反应序号填写)。
(3)写出反应⑦的反应方程式:__。
(4)实验室制备物质E时,装置如图所示(加热和夹持装置已省略)。试管a中实验前盛放的物质是___,实验后出现分层现象,分离物质D需要的玻璃仪器有___和烧杯等。

(5)某同学在试管b中加入6.0克乙酸和足量乙醇采用适当条件使反应充分进行,结束后在试管b回收到3.0克乙酸,则该同学在本次实验中制得乙酸乙酯的最大质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酸(HSO3Cl)在糖精、磺胺药的生产中有重要的应用。常温常压下氯磺酸为无色油状液体,沸点约为152℃,吸湿性和腐蚀性极强,在空气中发烟。学习小组在实验室用SO3和HCl来制备HSO3Cl并测定产品纯度。设计如下实验(夹持装置略去)。请回答下列问题:
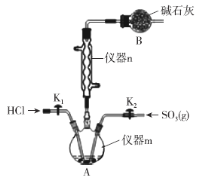
(1)仪器m的名称为___。
(2)已知:HSO3Cl中硫元素为+6价,O原子和Cl原子的最外层均满足8电子稳定结构,则HSO3Cl中的化学键为___ (填“离子键”、“极性键”或“非极性键”)。
(3)SO3可由五氧化二磷与浓硫酸共热制备,发生反应的化学方程式为___。
(4)装置B的作用为___。由仪器n可知制备HSO3Cl的反应为___ (填“放热反应”或“吸热反应”)。
(5)HSO3Cl纯度的测定(仪器m中得到的HSO3Cl中常溶有少量的SO3):
i.取25.0g产品溶于水中,加入过量的Ba(NO3)2溶液充分反应后,过滤。
ii.向滤液中加入过量的AgNO3溶液,过滤、洗涤、干燥、称量,测量所得沉淀AgCl的质量为28.7g。
①HSO3Cl遇水发生反应的化学方程式为___。
②产品HSO3Cl的纯度为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com