
| 成分 含量/% 阶段 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
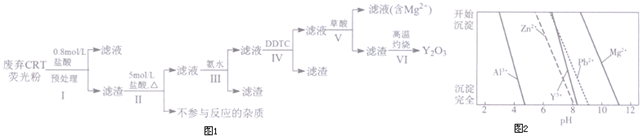
分析 废弃CRT荧光粉的化学组成为Y2O3、ZnO、Al2O3、PbO2、MgO等,加盐酸,过滤,滤渣主要含有Y2O3,还有少量的PbO2、ZnO、Al2O3、MgO,再加5mol/L的盐酸,PbO2与HCl发生氧化还原反应,生成氯气和PbCl2,Y2O3转化为Y3+,过滤,滤液中含有Pb2+和Y3+、Al3+、Zn2+、Mg2+,再加氨水,Al3+形成Al(OH)3沉淀,过滤,滤液中含有Pb2+和Y3+、Zn2+、Mg2+,加DDTC除去溶液中的Pb2+和Zn2+,过滤,滤液中加草酸,生成Y2(C2O4)3沉淀,过滤,滤渣为Y2(C2O4)3固体,高温灼烧Y2(C2O4)3生成Y2O3;
(1)进行原料预处理可以除去部分ZnO和Al2O3,富集稀土元素等;
(2)PbO2与HCl发生氧化还原反应,生成氯气和PbCl2,根据原子守恒和得失电子守恒写出方程式;
(3)步骤Ⅲ是用氨水除去溶液中的Al3+;
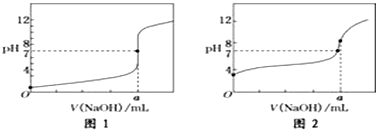
(4)根据流程分析;由图2可知Zn2+、Pb2+与Y3+沉淀的pH相近;
(5)根据Ksp[Y2(C2O4)3]=c2(Y3+)×c3(C2O42-)计算;
(6)草酸钇隔绝空气加热可以得到Y2O3和CO、CO2.
解答 解:废弃CRT荧光粉的化学组成为Y2O3、ZnO、Al2O3、PbO2、MgO等,加盐酸,过滤,滤渣主要含有Y2O3,还有少量的PbO2、ZnO、Al2O3、MgO,再加5mol/L的盐酸,PbO2与HCl发生氧化还原反应,生成氯气和PbCl2,Y2O3转化为Y3+,过滤,滤液中含有Pb2+和Y3+、Al3+、Zn2+、Mg2+,再加氨水,Al3+形成Al(OH)3沉淀,过滤,滤液中含有Pb2+和Y3+、Zn2+、Mg2+,加DDTC除去溶液中的Pb2+和Zn2+,过滤,滤液中加草酸,生成Y2(C2O4)3沉淀,过滤,滤渣为Y2(C2O4)3固体,高温灼烧Y2(C2O4)3生成Y2O3;
(1)由表格数据可知:进行原料预处理可以除去部分ZnO和Al2O3,富集稀土元素;在后续操作中能降低耗酸量等,
故答案为:除去ZnO和Al2O3;富集稀土元素;降低后续耗酸量;
(2)PbO2与HCl发生氧化还原反应,生成氯气和PbCl2,则反应的方程式为:PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O,
故答案为:PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(3)由流程分析可知,步骤Ⅲ是用氨水除去溶液中的Al3+,其反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(4)根据流程分析可知,步骤Ⅳ中除杂试剂DDTC除去的杂质离子有;由图2可知Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离,所以不能通过直接加碱的方法除去Zn2+、Pb2+;
故答案为:Zn2+、Pb2+;Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离;
(5)已知:当离子浓度小于10-5mol/L时,沉淀就达完全,Ksp[Y2(C2O4)3]=c2(Y3+)×c3(C2O42-)=(10-5)2×c3(C2O42-)=8.0×10-28,则c(C2O42-)=$\root{3}{\frac{8.0×1{0}^{-28}}{(1{0}^{-5})^{2}}}$=2.0×10-6mol/L,故答案为:2.0×10-6;
(6)草酸钇隔绝空气加热可以得到Y2O3和CO、CO2,其反应的方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑,故答案为:Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.
点评 本题考查了物质的分离提纯实验操作,题目涉及到氧化还原、出除杂质、溶度积常数的应用等,题目难度中等,注意根据题意写出有关反应的方程式,做题时注意根据物质的性质正确判断反应物和生成物,用守恒的方法去书写.


科目:高中化学 来源: 题型:解答题
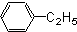 芳香烃,(7)
芳香烃,(7)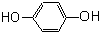 酚,(8)
酚,(8)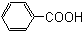 芳香酸.
芳香酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol•L-1FeCl3溶液中,Na+、NH4+、HCO3-、ClO-一定大量共存 | |
| B. | 常温下,某溶液中由水电离出的c(H+)=1×10-amol•L-1,则该溶液一定pH=a | |
| C. | 相同物质的量浓度下列溶液:①NH4Al(SO4)2;②NH4Cl;③CH3COONH4;④NH3•H2O.其中c(NH4+)由大到小的顺序是①>②>③>④ | |
| D. | AgCl悬浊液中存在如下平衡:AgCl(s)?Ag+(aq)+Cl-(aq).向其中加入少量NaCl晶体,平衡逆向移动,故AgCl溶解度减少,溶度积Ksp也减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步制取 电解二氧化锰(EMD)的工艺流程如下:
用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步制取 电解二氧化锰(EMD)的工艺流程如下: Fe(OH)3+3H+,加入CaCO3后,由于CaCO3(s)
Fe(OH)3+3H+,加入CaCO3后,由于CaCO3(s) Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去.
Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个信号,强度之比为1:1 | B. | 三个信号,强度之比为3:2:1 | ||
| C. | 两个信号,强度之比为3:1 | D. | 三个信号,强度之比为1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂能够改变反应的反应热 | |
| B. | 催化剂能够改变反应物的活化分子百分数 | |
| C. | 催化剂能改变反应物的转化率 | |
| D. | 催化剂通过升高反应的活化能来加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素位于同一周期 | B. | b+1=d-1 | ||
| C. | 氢化物稳定性:H2Y>HZ | D. | 离子的氧化性:W3+>X+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com