
现有下列几个离子反应:
①Cr2O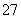 +14H++6Cl-===2Cr3++3Cl2↑+7H2O
+14H++6Cl-===2Cr3++3Cl2↑+7H2O
②2Fe2++Br2===2Fe3++2Br-
③2Fe3++SO2+2H2O===2Fe2++SO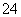 +4H+
+4H+
下列有关性质的比较中正确的是( )
A.氧化性:Cr2O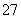 >Cl2>Fe3+
>Cl2>Fe3+
B.氧化性:Cl2>Br2>Cr2O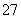
C.还原性:SO2<Fe2+<Br-
D.还原性:Cl->Cr3+>Fe2+
科目:高中化学 来源: 题型:
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 )。
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
实验证明,多数能自发进行的反应都是放热反应。对此说法的理解正确的是( )
A.所有的放热反应都是自发进行的
B.所有的自发反应都是放热的
C.焓变是影响反应是否具有自发性的一个重要因素
D.焓变是决定反应是否具有自发性的唯一判据
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可用浓盐酸分别与KMnO4、MnO2、KClO3等多种物质在一定条件下反应制取氯气
①上述反应中,HCl表现的性质是________、________。
②在常温下,浓盐酸与KMnO4可反应生成氯气,KMnO4中的Mn被还原为+2价,该反应的化学方程式:__________________________________________________________________
________________________________________________________________________。
③KMnO4、MnO2和Cl2的氧化性由强到弱的顺序是:
________________________________________________________________________。
④已知KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O,用双线桥表示该反应的电子转移情况:
________________________________________________________________________。
⑤用上述三种物质分别制取标准状况下3.36 L氯气时,转移的电子数分别是__________________(NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应:2S2Cl2+2H2O===4HCl+SO2↑+3S↓。对该反应的说法正确的是(双选)( )
A.S2Cl2既作氧化剂又作还原剂
B.H2O作还原剂
C.每生成1 mol SO2转移3 mol电子
D.氧化产物与还原产物物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
某容器中发生了一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO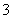 、N2、Cl-六种粒子,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列判断中正确的是(双选)( )
、N2、Cl-六种粒子,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列判断中正确的是(双选)( )
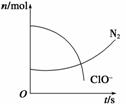
A.还原剂是CN-,氧化产物只有N2
B.氧化剂是ClO-,还原产物是HCO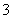
C.配平后氧化剂与还原剂的化学计量数之比为5∶2
D.标准状况下若生成2.24 L N2,则转移1 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,在高温下不能自发进行的是( )
A.(NH4)2CO3(s)====NH4HCO3(s)+NH3(g)
B.2N2O5(g)====4NO2(g) +O2(g)
C.MgCO3(s)=====MgO(s)+CO2(g)
D.CO(g)====C(s)+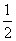 O2(g)
O2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(g)
 cC(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系式中能说明反应已达到平衡状态的是( )
cC(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系式中能说明反应已达到平衡状态的是( )
A.av正(A)=bv正(B) B.bv正(A)=av逆(B)
C.av正(C)=cv正(A) D.av正(A)=bv逆(B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com