
【题目】已知NA为阿伏加德罗常数,下列说法中不正确的是( )
A.常温常压下,16gO2和O3的混合气体中含有N A个原子
B.17克OH-所含电子数目为10NA
C.标准状况下,11.2L氩气中含有0.5NA个氦原子
D.1L2mol·L-1的硫酸镁溶液中含有的氧原子为8NA个
【答案】D
【解析】
根据题中阿伏加德罗常数可知,本题考查阿伏加德罗常数的应用和计算,运用阿伏加德罗常数的计算公式分析。
A. 16gO2和O3的混合气体中,氧原子的物质的量为![]() ,即16gO2和O3的混合气体中含有N A个原子,A项正确;
,即16gO2和O3的混合气体中含有N A个原子,A项正确;
B. 一个OH-所含电子数为10个,17克OH-的物质的量为![]() ,则17克OH-所含电子数目为10NA,B项正确;
,则17克OH-所含电子数目为10NA,B项正确;
C. 标准状况下,11.2L氩气的物质的量为![]() ,氩气是单原子分析,因此标准状况下,11.2L氩气中含有0.5NA个氦原子,C项正确;
,氩气是单原子分析,因此标准状况下,11.2L氩气中含有0.5NA个氦原子,C项正确;
D. 1L2mol·L-1的硫酸镁的物质的量为![]() ,则
,则![]() , 但1L2mol·L-1的硫酸镁溶液中,水中也含有氧原子,所以氧元素数大于8NA个,D项错误;
, 但1L2mol·L-1的硫酸镁溶液中,水中也含有氧原子,所以氧元素数大于8NA个,D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol氦气中有2NA个氦原子B.14 g氮气中含6.02×1023个氮分子
C.常温常压下,32gO3含有的原子数为2NAD.18 g水中所含的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,相同温度下,在容器Ⅰ和Ⅱ中分别充入等物质的量的HI,发生反应2HI(g) ![]() H2(g)+I2(g)。下列关于反应起始时容器Ⅰ和Ⅱ中活化分子的说法不正确的是( )
H2(g)+I2(g)。下列关于反应起始时容器Ⅰ和Ⅱ中活化分子的说法不正确的是( )
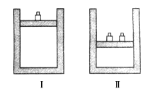
A. Ⅰ和Ⅱ中活化分子数相同
B. Ⅰ和Ⅱ中活化分子百分数相同
C. Ⅰ和Ⅱ中单位体积内活化分子数相等
D. Ⅰ中化学反应速率比Ⅱ中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:丰富的 CO2 可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机,同时又可缓解由 CO2累积所产生的温室效应,实现 CO2的良性循环。
(1)目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H=+41.3kJ/mol
CO(g)+H2O(g)△H=+41.3kJ/mol
第二步:2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g)△H=-210.5kJ/mol
C2H4(g)+2H2O(g)△H=-210.5kJ/mol
①CO2加氢合成乙烯的热化学方程式为___。
②一定条件下的密闭容器中,上述反应达到平衡后,要加快反应速率并提高 CO2 的转化率,可以采取的措施是___(填字母)。
A.减小压强 B.增大 H2浓度 C.加入合适的催化剂 D.分离出水蒸气
(2)另一种方法是将 CO2 和 H2 在 230℃催化剂条件下生成甲醇蒸气和水蒸气,在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示。若在 10L 恒容密闭容器中投入1molCO2 和 2.75molH2,发生反应: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
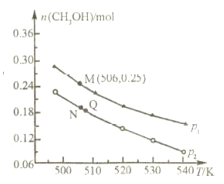
①能判断该反应达到化学平衡状态的是___(填字母)。
A.c(H2):c(CH3OH)=3:1
B.容器内氢气的体积分数不再改变
C.容器内气体的密度不再改变
D.容器内压强不再改变
②上述反应的△H___0(填“>”或“<”),图中压强 p1 ___p2(填“>”或“<”)。
③经测定知 Q 点时容器的压强是反应前压强的 9/10,则 Q 点 CO2的转化率为___。
④M 点时,该反应的平衡常数 K=___ (计算结果保留两位小数)。
(3)用生石灰吸收 CO2 可生成难溶电解质 CaCO3,其溶度积常数 Ksp=2.8×10-9。现有一物质的量浓度为2×10-4mol/L 纯碱溶液,将其与等体积的 CaCl2溶液混合,则生成沉淀所需 CaCl2溶液的最小浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁(![]() )广泛应用于航天、化工等领域中,其电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂),下列说法正确的是( )
)广泛应用于航天、化工等领域中,其电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂),下列说法正确的是( )
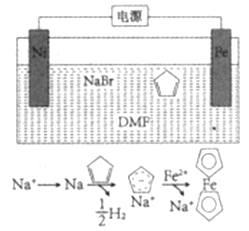
A. 该电解池的阳极反应Fe-3e-=Fe3+
B. DMF溶液可用水替代
C. 电解液中钠离子起到催化剂的作用
D. 该过程中消耗2mol环戊二烯理论上产生22.4L的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3X(g)+Y(g) ![]() W(g)+2M(g) ΔH=-akJ/mol(a﹥0)。一定温度下,在体积恒定的密闭容器中,加入3mol X(g)与1mol Y(g),下列说法正确的是( )
W(g)+2M(g) ΔH=-akJ/mol(a﹥0)。一定温度下,在体积恒定的密闭容器中,加入3mol X(g)与1mol Y(g),下列说法正确的是( )
A. 充分反应后,放出热量为akJ
B. 当反应达到平衡状态时,X与W的物质的量浓度之比一定为3∶1
C. 当X的物质的量分数不再改变,表明该反应已达平衡
D. 若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. ![]() 氨水加水稀释后,溶液中所有离子的浓度都减小
氨水加水稀释后,溶液中所有离子的浓度都减小
B. 将![]() 溶液与
溶液与![]() 溶液混合可制取
溶液混合可制取![]()
C. 直接蒸干![]() 溶液就可以得到
溶液就可以得到![]() 固体
固体
D. 浓度相同的①![]() ;②
;②![]() ;③
;③![]() 。三种溶液中的
。三种溶液中的![]() :③>①>②
:③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用邻苯二甲酸氢钾溶液来滴定NaOH溶液有下列操作:
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是________,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是________,选用指示剂是________。
(2)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:

某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=(19.98+20.00+20.80+20.02)/4mL=20.20mL,他的计算合理吗?理由是__________。
(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作__________;滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应 10NaN3+2KNO3 =K2O+5X+16N2↑,下列说 法不正确的是( )
A.X 的化学式为 Na2O
B.上述反应中 NaN3 被氧化,KNO3 发生还原反应
C.每生成 1.6molN2,则转移的电子为 3 mol
D.若被氧化的 N 原子的物质的量为 3mol,则氧化产物比还原产物多 1.4 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com