
| m |
| M |
| 160g |
| 160g/mol |
| ||


科目:高中化学 来源: 题型:
| A、氧化性:B2>C2>A2 |
| B、在含有C-和A-的溶液中加入B2,C-优先发生反应 |
| C、还原性:B->C->A- |
| D、在含有B2和C2的溶液中加入A-,B2优先发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2O2的电子式: | ||
B、Cl的原子结构示意图: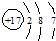 | ||
C、质子数是82,中子数是122的铅原子:
| ||
D、CO2的比例模型: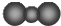 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 已知硝酸与金属发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.则:
已知硝酸与金属发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.则:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com