
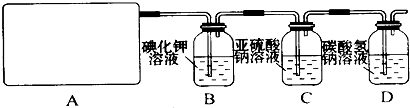

分析 (1)根据反应物的状态及反应条件选择发生装置;
(2)氯气有强氧化性,亚硫酸根离子有还原性,所以氯气和亚硫酸根离子能发生氧化还原反应生成硫酸根离子、氯离子和氢离子;如果亚硫酸钠被氧化会生成硫酸钠,根据硫酸根离子的检验方法检验即可;
(3)氯气和水反应生成盐酸和次氯酸,盐酸能和碳酸氢根离子反应生成二氧化碳.
解答 解:(1)A部分用于制取Cl2,根据所给Cl2的生成反应的反应物状态和反应是否需要加热选择气体发生装置,应选属于“固+液$\frac{\underline{\;\;△\;\;}}{\;}$气”型的b,故答案为:b;
(2)Na2SO3氧化的产物为Na2SO4,确定存在SO42-即可证明Na2SO3已部分被氧化.检验时,应取C中溶液少许于洁净试管中,先加稀HCl至不再产生气体以排除SO32-的干扰,然后再加入BaCl2溶液,若产生白色沉淀,则证明Na2SO3已部分被氧化,
故答案为:取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化;
(3)进入D的Cl2与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO,HCl能与NaHCO3反应,离子方程式为H++HCO3-=CO2↑+H2O,HClO因酸性比H2CO3弱而不能与NaHCO3反应,故答案为:Cl2+H2O═H++Cl-+HClO、H++HCO3-═CO2↑+H2O.
点评 本题考查氯气的制备以及性质检验,为高频考点,侧重于学生的分析、实验能力的考查,题目难度中等,注意亚硫酸根离子的检验首先要排除硫酸根离子的干扰.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 容器中H2O、CO、H2的物质的量之比为1:1:1 | |
| B. | v正(CO)=v逆(H2O) | |
| C. | 生成n molCO的同时生成n mol H2 | |
| D. | 1mol H-H键断裂同时生成2mol H-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙烷 | 丙烷 | 丁烷 | |
| 熔点(℃) | -183.3 | -189.7 | -138.4 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要检验溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 要检验蔗糖的水解产物,将蔗糖的水解液加入到新制的氢氧化铜悬浊液中,加热至沸腾观察是否有红色沉淀产生 | |
| C. | 在进行溴乙烷与NaOH乙醇溶液反应的实验中,将反应产生的气体直接通入到酸性高锰酸钾溶液中来检验产生的气体是否为乙烯 | |
| D. | 将铜丝在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,铜丝恢复成原来的红色,取出,铜丝又会变为黑色,反复几次,用氢氧化铜悬浊液可以证明是否生成了乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、油脂、天然橡胶和蛋白质分子中均含有双键 | |
| B. | 相同物质的量的甲基、羟基或氨基所含的电子数目相同 | |
| C. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数不为定值 | |
| D. | 利用红外光谱仪记录的红外光谱图可以初步推测有机化合物中官能团的类别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于分离苯和溴苯的混合物 | |
| B. | 装置②可用于吸收氨气,且能够防止倒吸 | |
| C. | 以NH4Cl为原料,装置③可用于制备NH3 | |
| D. | 剩用装置④可收集Cl2、H2等气体,盛满水时还能收集NO等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
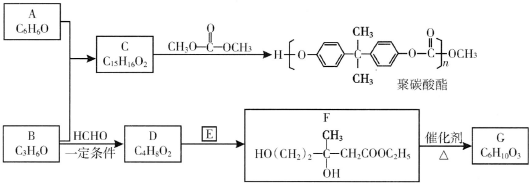
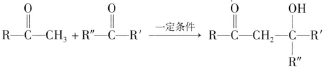 (R、R′、R″为氢原子或烃基)
(R、R′、R″为氢原子或烃基) ,E的分子式是C4H8O2,F生成G的反应类型是取代反应?
,E的分子式是C4H8O2,F生成G的反应类型是取代反应? .G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).
.G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
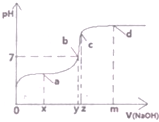 (1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.
(1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com