
【题目】2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 .
请回答下列问题: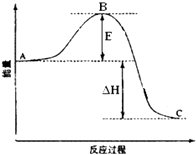
(1)图中A、C分别表示、 , E的大小对该反应的反应热有无影响? . 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? , 理由是;
(2)图中△H=kJmol﹣1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式;
(4)如果反应速率υ(SO2)为0.05molL﹣1min﹣1 , 则υ(O2)=molL﹣1min﹣1、υ(SO3)=molL﹣1min﹣1;
(5)已知单质硫的燃烧热为296kJmol﹣1 , 计算由S(s)生成3molSO3(g)的△H(要求计算过程).
【答案】
(1)反应物能量;生成物能量;无;降低;因为催化剂改变了反应的历程使活化能E降低
(2)﹣198
(3)SO2+V2O5=SO3+2VO2 4VO2+O2=2V2O5
(4)0.025;0.05
(5)解:单质硫的燃烧热为296kJmol﹣1,
热化学方程式为:①S(s)+O2(g)=SO2(g)△H1=﹣296 KJmol﹣1,
已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1.
热化学方程式为:②SO2(g)+1/2O2(g)SO3(g)△H2=﹣99 KJmol﹣1 ;
依据盖斯定律,②+①得到:③S(s)+O2(g)=SO3(g)△H=(△H1+△H2)KJ/mol;
计算由S(s)生成3molSO3(g)③×3得到:
3 S(s)+9/2O2(g)=3SO3(g)△H=3(△H1+△H2)=﹣1185 KJmol﹣1,
故△H =1185 KJmol﹣1.
【解析】解:(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,催化剂改变反应速率通过参与反应过程,降低活化能实现,
所以答案是:反应物总能量;生成物总能量;无;降低;因为催化剂改变了反应的历程使活化能E降低;(2)因1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 , 图象中的能量变化是反应2SO2(g)+O2(g)2SO3(g)反应过程的能量变化;所以2molSO2(g)氧化为2molSO3的△H=﹣198kJmol﹣1 , 则2SO2(g)+O2(g)=2SO3(g)△H=﹣198KJmol﹣1 , 所以答案是:﹣198;(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物反应的化学方程式为:SO2+V2O5=SO3+2VO2;四价钒化合物再被氧气氧化,依据化合价变化和氧化还原反应分析得到反应的化学方程式为:4VO2+O2=2V2O5 , 所以答案是:SO2+V2O5=SO3+2VO2 4VO2+O2=2V2O5;(4)反应的化学方程式为:2SO2(g)+O2(g)2SO3(g),反应速率之比等于系数之比,v(SO2):v(O2):v(SO3)=2:1:2,反应速率υ(SO2)为0.05molL﹣1min﹣1 , 依据比例计算得到v(O2)=0.025mol/Lmin;v(SO3)=0.05molL﹣1min﹣1 ,
所以答案是:0.025;0.05;(5)单质硫的燃烧热为296kJmol﹣1 , 热化学方程式为:①S(s)+O2(g)=SO2(g)△H1=﹣296 KJmol﹣1 , 已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 . 热化学方程式为:
②SO2(g)+1/2O2(g)SO3(g)△H2=﹣99 KJmol﹣1 ;依据盖斯定律,②+①得到:③S(s)+O2(g)=SO3(g)△H=(△H1+△H2)KJ/mol;计算由S(s)生成3molSO3(g)③×3得到:
3 S(s)+9/2O2(g)=3SO3(g)△H=3(△H1+△H2)=﹣1185 KJmol﹣1 , 所以答案是:﹣1185 KJmol﹣1 .


科目:高中化学 来源: 题型:
【题目】把铝条放入盛有过量稀盐酸的试管中,不影响产生氢气速率的因素是
A. 加少量浓盐酸 B. 加少量NaCl溶液
C. 加少量NaNO3固体 D. 加少量Na2SO4固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化剂中,起氧化作用的是X2O72-离子,在溶液中0.2mol该离子恰好能使0.6mol的SO32-离子完全氧化,则X2O72-离子还原后X的化合价为
A. +1 B. +2 C. +3 D. +4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的污染物有固体悬浮颗粒、一氧化碳、碳氢化合物、氮氧化合物铅及硫氧化合物等。下列说法中正确的是
A. 固体悬浮颗粒是造成雾霾天气的一种重要因索
B. 一氧化碳、氮氧化合物是酸雨形成的主要因素
C. 硫氧化合物不仅能形成酸雨,还能形成光化学烟雾
D. 汽车尾气可通过净化装置将碳氢化合物还原成CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A. V(NaOH)=0时,c(H+)=1×10-2mol/L
B. V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C. V(NaOH)=10mL时,c(H+)=1×10-7mol/L
D. V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在实验室模拟工业“侯氏制碱法”原理制取NaHCO3 . 下图是该学习小组进行模拟实验时所用到的主要装置. 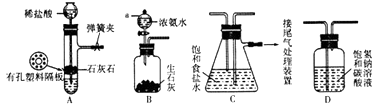
请回答下列问题:
(1)B装置中仪器a的名称是 .
(2)C装置中发生的现象是 , 反应的化学方程式是
(3)检验A装置气密性的方法是:塞紧带长颈漏斗的橡胶塞,夹紧弹簧夹后,向漏斗里注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,若 . 说明装置不漏气.
(4)D是连接在装置A与装置C之间的气体净化装置,装置D的作用是 .
(5)实验时向饱和NaCl溶液中先通入NH3 , 再通入CO2的原因是 .
(6)设计实验方案,检验NaHCO3产品中是否含有氯化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com