
【题目】亚硝酸钠在食品工业常用作肉类的发色剂,有一定的的氧化性,亚硝酸钠暴露于空气中会与氧气反应生成硝酸钠,一种模拟工业用纯碱溶液吸收氮氧化物制备NaNO2的实验装置如下:
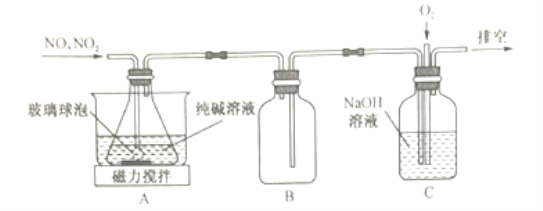
已知:NO2+NO+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O
回答下列问题:
(1)若当反应时NO与NO2的物质的量之比为1:1时,A中发生反应的化学方程式为________。
(2)装置B的作用是____________________;装置C中通入O2的目的是_______________。
(3)反应后A中溶液经蒸发浓缩、结晶及干燥得到产品。
甲同学取少量的产品溶于水并用稀盐酸酸化,用湿润的KI淀粉试纸检验,试纸变蓝,得出产品为NaNO2。乙同学认为结论不可靠,其理由是____________________________。
(4)现有V L某NaOH溶液能完全吸收n mol NO2和 m mol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为______________ mol/L。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=________。
【答案】NO+NO2+Na2CO3=2NaNO2+CO2 安全瓶(防止倒吸) 将NO氧化,确保被完全吸收 产品中若含NaNO3,在酸性条件下NO3-也可将I-氧化为I2 ![]() 3∶2
3∶2
【解析】
(1)Na2CO3水解产生NaOH,使溶液显碱性,结合信息①方程式NO2+NO+2NaOH=2NaNO2+H2O,可得该步反应方程式;
(2)在C中NOx与NaOH反应会导致容器中气体压强减小,引起倒吸现象,装置B可以缓冲,防止倒吸现象的发生;向装置C中通入O2,可以使NO完全氧化,防止尾气造成大气污染;
(3)在酸性条件下,H+、NO3-起硝酸作用,表现强氧化性;
(4)①根据气体和氢氧化钠的关系式计算;
②根据二氧化氮、一氧化氮和氢氧化钠反应的方程式中各个物理量之间的关系式计算。
(1)Na2CO3是强碱弱酸盐,水解产生NaOH,使溶液显碱性,结合信息①方程式可得若当反应时NO与NO2的物质的量之比为1:1时,A中发生反应的化学方程式为NO+NO2+Na2CO3=2NaNO2+CO2;
(2)在装置A中用纯碱溶液吸收NO、NO2的混合气体制取NaNO2,由于氮氧化合物会造成大气污染,形成酸雨、光化学烟雾,因此可利用NaOH溶液进行尾气吸收,为防止在用NaOH溶液吸收时,由于气体溶解导致导气管中气体压强过小而引起倒吸现象的发生,可以安装一个安全瓶,因此装置B的作用是安全瓶,防止液体倒吸进入反应装置A中;
根据题目已知的反应方程式可知:若n(NO2):n(NO)≥1:1时,气体可以完全被吸收,若NO的物质的量比NO2多,会有NO逸出,若再向装置C中通入O2,就可以将NO氧化为NO2,而被NaOH溶液充分吸收。即装置C中通入O2的目的是将NO氧化,确保被完全吸收;
(3)A中反应后的溶液中含有NaNO2、NaNO3,甲同学取少量的产品溶于水并用稀盐酸酸化,用湿润的KI淀粉试纸检验,试纸变蓝,就得出结论说产品为NaNO2这个结论不可靠,原因是H+、NO3-起HNO3的作用,具有强的氧化性,也可以将KI氧化为I2,而使淀粉试纸变为蓝色;
(4)①用V L某NaOH溶液能完全吸收n mol NO2和 m mol NO组成的大气污染物。反应后产生NaNO2、NaNO3,根据物质组成,结合元素守恒,可知n(NaOH)=n(NaNO2)+n(NaNO3)=n(NO2)+n(NO)=(m+n)mol,根据物质的量浓度定义可得c(NaOH)=![]() =
=![]() mol/L;所以若气体完全被吸收,溶液中含有的NaOH的浓度最小为
mol/L;所以若气体完全被吸收,溶液中含有的NaOH的浓度最小为![]() mol/L;
mol/L;
②设原混合气体中NO2和NO的物质的量n和m,
NO2+NO+2NaOH=2NaNO2+H2O,
1 1 2
mmol mmol 2mmol
2NO2+2NaOH=NaNO2+NaNO3+H2O,
2 1 1
(n-m)mol ![]()
![]()
所得溶液中c(NO3-):c(NO2-)= ![]() :[2m+
:[2m+ ![]() ]mol=1:9,解得n:m=3:2。
]mol=1:9,解得n:m=3:2。


科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指
A.蒸馏B.蒸发C.升华D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1 ,
(2)2Ag(s)+1/2O2(g)=Ag2O(s) △H=-31.0kJ·mol-1,
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
A. -317.3kJ·mol-1 B. -379.3kJ·mol-1 C. -332.8kJ·mol-1 D. +317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当前,汽车尾气已成为许多城市空气的主要污染源。研究表明,含TiO2的混凝土或沥青可以部分消除汽车尾气中的氮氧化物,其原理如下
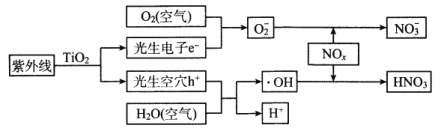
下列关于该“消除”过程的叙述不正确的是
A. 部分光能转变为化学能
B. 消除总变化为NO2+O2+H2O→HNO3
C. 消除反应能全天候发生
D. 使用纳米TiO2的消除效率更高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期的主族元素,其原子序数依次增大,A的原子电子层数等于其核外电子数,B与C可形成离子化合物CB2,D原子的M层电子数是K层电子数的3倍。
(1)写出A的简单阴离子的电子式是________。
(2)E的氢化物与C单质相比,沸点较低的是_________(填化学式)。
(3)C、E组成的化合物所含化学键的类型是______________。
(4)B、D、E按原子半径由大到小的顺序排列为_____________(填元素符号)。
(5)E的最高价氧化物对应的水化物化学式是____________
(6)若D和E可组成化合物D2E2 ,在该化合物中各原子最外层均达到8电子稳定结构,写出其结构式__________________
(7)写出E在元素周期表中的位置____________________________________。
(8)将D的最高价含氧酸的浓溶液露置空气中,质量会发生变化,体现了其对应酸的_____________性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是汽车尾气催化转化装置工作原理示意图:
![]()
![]()
![]()
![]()
![]()
下列说法不正确的是
A. 汽车尾气是雾霾成因之一,主要由CO、NO
B. 该过程中NO2既是生成物又是反应物
C. 整个过程中氧元素被还原,氮元素被氧化
D. 过程②中会有反应: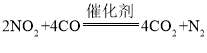
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]()
![]() +OH
+OH
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2+ +2e![]() Cu
Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收,其中Y是单质。
SO 2(g) + 2CO(g)![]() 2X(g)+Y(l)
2X(g)+Y(l)
为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(SO2)/mol·L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
c(CO)/mol·L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
下列说法不正确的是
A. X的化学式为CO2
B. 前1s内v(X)=" 1.00" mol·L-1·s-1
C. 该回收原理运用了SO2的还原性
D. 该温度下,此反应的平衡常数的数值是3.33×1036
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com