
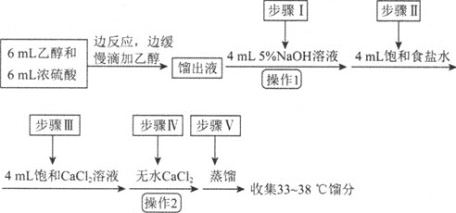
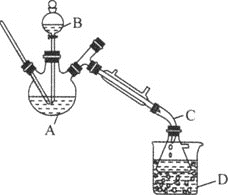
【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图![]() 夹持和加热装置已略去
夹持和加热装置已略去![]() 、有关数据和实验步骤如下:
、有关数据和实验步骤如下:
物质 | 相对分子质量 | 密度 | 沸点 | 在水中的溶解性 |
乙醇 | 46 |
| 78 | 互溶 |
乙醚 | 74 |
|
| 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物![]() 。
。
请回答下列问题:
(1)仪器C的名称为_____。
(2)由乙醇制备乙醚的总反应为![]() ,此反应分两步进行,第一步反应的化学方程式为
,此反应分两步进行,第一步反应的化学方程式为![]() ,则第二步反应的化学方程式为_______。
,则第二步反应的化学方程式为_______。
(3)反应过程中,仪器B的末端应浸入反应液中,原因是___。
(4)仪器D中盛有冰水混合物,其作用为___。
(5)操作1的名称为____,操作2的名称为___。
(6)若省略步骤Ⅱ会导致的后果是_______。
(7)若实验过程中共加入18mL乙醇,最终得到8.7g乙醚,则乙醚的产率为______![]() 计算结果精确到
计算结果精确到![]() 。
。
【答案】牛角管(或尾接管) ![]() 防止滴入的乙醇受热被蒸发,提高产物的产率,减少杂质 使乙醚冷凝为液体以便收集 分液 过滤 用饱和氯化钙溶液洗涤乙醚粗品时,析出氢氧化钙沉淀 73.6%
防止滴入的乙醇受热被蒸发,提高产物的产率,减少杂质 使乙醚冷凝为液体以便收集 分液 过滤 用饱和氯化钙溶液洗涤乙醚粗品时,析出氢氧化钙沉淀 73.6%
【解析】
考查有机物的制备,装置A为制备装置,装置D为收集装置,然后按照题中所给信息完成分析;
本实验的目的是制备乙醚,实验原理是2CH3CH2OH![]() CH3CH2OCH2CH3+H2O,
CH3CH2OCH2CH3+H2O,
(1)根据仪器C的特点,仪器C为牛角管或尾接管;
(2)总反应是第一步和第二步的和,即第二步反应的化学方程式为CH3CH2OSO2OH+CH3CH2OH![]() H2SO4+CH3CH2OCH2CH3;
H2SO4+CH3CH2OCH2CH3;
(3)乙醇受热易挥发,该反应加热,造成滴入的乙醇挥发,浪费原料,因此末端浸入反应液可以防止滴入的乙醇受热被蒸发,可以提高乙醇的利用率,提高产物的产率,减少杂质;
(4)依据表格中的数据,乙醚的沸点是34.6℃,从三颈烧瓶中出来的是乙醚气体,因此仪器D中盛有冰水混合物,可以使乙醚气体转变为液体,便于收集;
(5)蒸出的乙醚中混有乙醇,乙醇溶于水,乙醚不溶于水,操作1出现分层,采用分液方法进行分离,得到粗乙醚;操作2加入无水氯化钙,因此操作2应是过滤;
(6)乙醚在饱和食盐水比在水中更难溶,加入饱和食盐水,目的是除去过量的NaOH溶液,缺少该步骤,加入饱和CaCl2溶液,CaCl2与过量的NaOH反应生成Ca(OH)2沉淀,不利于产品的分离;
(7)18mL乙醇的物质的量为18mL×0.816g·mL-1÷46g·mol-1≈0.319mol,根据生成乙醚的反应方程式,得出乙醚的物质的量为0.319mol/2=0.1595mol,其质量为0.1595mol×74g·mol-1=11.803g,产率为8.7g÷11.803g×100%≈73.6%。


科目:高中化学 来源: 题型:
【题目】由一种短周期金属元素和一种非金属元素组成的化合物X可与水发生复分解反应。某校兴趣小组用如图装置(夹持装置略去)对其进行探究实验。
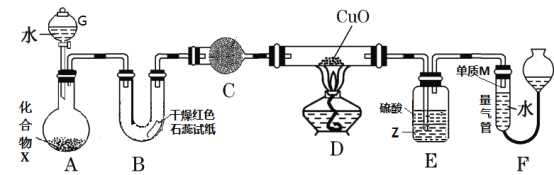
(1)仪器G的名称是_____________________,B中红色石蕊试纸变蓝,则单质M的电子式为___________________。
(2)化合物X中金属元素和非金属元素质量比为69:14,写出X与水反应的化学方程式:_________________________________。
(3)C中的试剂名称为___________________________。
(4)实验时,装置D中硬质玻璃管内的现象为_________________________。
(5)裝置E中试剂Z为___________(填化学式),装置E的作用是_________________。
(6)若不通过E、F两装置,请设计实验方案证明D中发生了反应(不通过观察D
中固体颜色发生变化)________________________________________ 。
(7)若装置A中固体样品含有杂质(杂质不参与反应),某同学通过测定F中单质M在标准状况下的体积和固体样品的质量,以确定固体样品中X的质量分数,判断该方案是否可行,并说明原因:_________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是( )
A. T1时0~10 min NO2的平均反应速率为0.15 mol·L-1·min -1
B. T2时CH4的平衡转化率为70.0%
C. 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种应用较广的催化剂,易水解。以低品位铜矿砂(主要成分CuS)为原料制备氯化亚铜的路线如下:
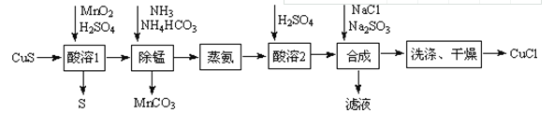
(1)酸溶1步骤中加入MnO2的作用是______。
(2)除锰步骤Mn2+转化为MnCO3沉淀,该反应的离子方程式为______。溶液中CuSO4转变为Cu(NH3)4CO3留在溶液中。
(3)蒸氨步骤会得到CuO固体,该步骤在减压条件下进行的原因是______。
(4)合成步骤加入Na2SO3的速率不宜过快,否则会产生SO2气体,除可能与酸溶时硫酸过量有关,还可能的原因是______。
(5)有工艺将合成步骤的NaCl与Na2SO3换为NH4Cl和(NH4)2SO3,则可获得一种可作为氮肥的副产品,其化学式为_____。
(6)洗涤步骤先用______洗,再用无水乙醇洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷与甲醇(CH3OH,液态)都属于清洁能源,已知每摩尔甲烷完全燃烧生成液态水和 CO2时放出的热量约为 890.3kJ,每摩尔甲醇完全燃烧生成液态水和 CO2 时放出的热量约为 726.0kJ。
(1)相同质量的甲烷与甲醇完全燃烧,生成液态水和 CO2 时放出热量较多的是_____。从共用电子对的偏离情况来看,甲烷分子中的共价键属于_____,甲醇分子的结构可以看成是甲烷分子中的一个H 原子被原子团(—OH)取代而得到,请根据甲烷的电子式写出甲醇分子的电子式_____。
(2)甲醇燃烧的热化学方程式为_____,1mol 甲醇完全燃烧,若生成水蒸气和 CO2 则放出的热量_____726.0kJ(填>、<或=)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧的元素符号是________(填写元素符号)。
(2)表中金属性最强的元素是____(填元素符号),该元素在周期表中的位置是_______。
(3)写出①、③、④最高价氧化物对应的水化物两两反应的化学方程式
_________________________________
_________________________________
_________________________________
(4)请设计一个实验方案,比较⑦、⑧非金属性的强弱(用化学方程式表示):_______。
(5)③、⑦两种元素形成的化合物的电子式为_____,⑦的气态氢化物的电子式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界水体中的碳元素主要以碳酸盐、碳酸氢盐和有机物形式存在。水体中有机物含量是水质的重要指标,常用总有机碳衡量(总有机碳=![]() )。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。
)。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。

步骤1:量取50 mL水样,加入足量硫酸,加热,通N2,并维持一段时间(装置如图,夹持类仪器省略)。
步骤2:再向水样中加入过量的K2Cr2O7溶液(可将有机物中的碳元素氧化成CO2),加热,充分反应,生成的CO2完全被100mL 0.206 mol·L-1的Ba(OH)2溶液吸收。
步骤3:将吸收CO2后的浊液过滤并洗涤沉淀,再将洗涤得到的滤液与原滤液合并,加水配制成500mL溶液。量取25.00mL溶液于锥形瓶中,加入几滴酚酞试剂,并滴加0.05mol·L-1的H2C2O4溶液,发生反应:Ba(OH)2+H2C2O4===BaC2O4↓+2H2O 恰好完全反应时,共消耗H2C2O4溶液20.00 mL。
(1)步骤1的目的是____。
(2)用H2C2O4溶液滴定至终点时,溶液颜色变化是____。
(3)计算水样的总有机碳(以mg·L-1表示),并写出计算过程。____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com