
反应:N2(g)+3H2(g) 2NH3(g) △H<0。在等容条件下进行。体系中各物质浓度随时间变化的曲线如图所示,回答问题:
2NH3(g) △H<0。在等容条件下进行。体系中各物质浓度随时间变化的曲线如图所示,回答问题:
(1)图中B为 (填“N2”、“H2”或“NH3”)计算反应从开始→达平衡时H2的反应速率v(H2)=
(2)下图是在某温度下反应达到平衡,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示体系中各物质的浓度随时间变化的趋势(不需计算新平衡时的具体浓度,只要新平衡时浓度处于一个合理范围内即可。曲线上必须标出N2、H2、NH3)。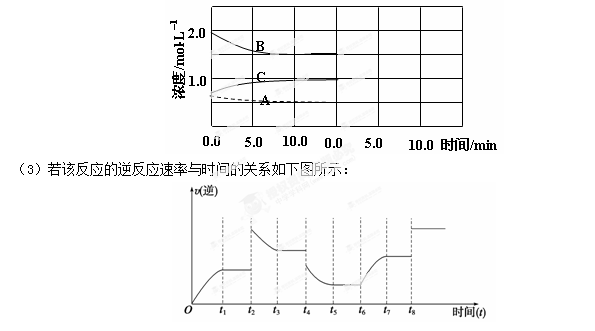
反应在t1、t3、t5、t7时都达到了平衡,而t2、t4、t6、t8时都改变了条件,试判断改变的条件是(填“升温”、“降压”……?等);t2时 ;t6时 ;t4时,平衡向 (填“正”或“逆”)反应方向移动。

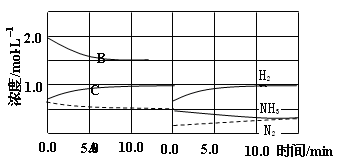
(3)升温(2分);增大N2或H2浓度(2分) 逆(2分)
解析试题分析:由图可知,B达到平衡时消耗了3mol/L,而A消耗了1mol/L,C生成了3mol/L,再由化学反应的系数可知A为氮气,B为氢气,C为氨气。而反应速率等于反应物浓度的变化量除以浓度变化所需的时间,因此氢气的反应速率为3除以20等于0.02摩尔每升每分。在达到新平衡时,氮气的浓度范围为0.25至0.5摩尔每升,氢气浓度范围为0.75至1.5摩尔每升。氨气的浓度范围为0至0.25摩尔每升。升高温度,反应速率增大,平衡向吸热的方向进行,。增大反应物浓度,正反应速率增大
考点:考查化学反应速率与化学平衡的相关知识点


科目:高中化学 来源: 题型:单选题
将H2(g)和Br2(g)充入恒容密闭容器中,恒温下发生反应H2(g)+Br2(g)  2HBr(g) (正反应放热),平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。 a与b的关系是
2HBr(g) (正反应放热),平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。 a与b的关系是
| A.a>b | B.a =b | C.a <b | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z三种气体,取X和Y按1︰1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( )
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( )
| A.33% | B.40% | C.50% | D.66% |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
100mL 6 mol / L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
| A.硫酸钾溶液 | B.醋酸 | C.氯化钠(固体) | D.盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在

 的可逆反应中,自反应开始至2 s末,氨的浓度由0变为0.4
的可逆反应中,自反应开始至2 s末,氨的浓度由0变为0.4 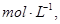 则以氢气的浓度变化表示该反应在2 s内的平均反应速率是
则以氢气的浓度变化表示该反应在2 s内的平均反应速率是
A.0.3 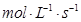 | B.0.4 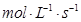 |
C.0.6 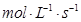 | D.0.8 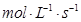 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分,每空2分)下图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答: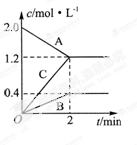
(1)该反应的反应物是 。
(2)该反应的化学方程式是 。
(3)若达到平衡状态的时间为2min,则A物质的平均反应速率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 | 铁的质量/g | 铁的 形态 | V(H2SO4) /mL | c(H2SO4) /mol·L-1 | 反应前溶液 的温度/℃ | 金属完全消 失的时间/s |
| 1 | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(17分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)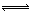 NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
2NO(g)+Cl2(g)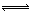 2ClNO(g) K2 ?H < 0 (II)
2ClNO(g) K2 ?H < 0 (II)
(1)4NO2(g)+2NaCl(s)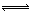 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol?L?1的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2-)和c(CH3COO?)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol?L?1,CH3COOH的电离常数K a=1.7×10-5mol?L?1,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com