



分析 (1)氯化铝的制备是金属铝和氯气之间反应的产物,浓盐酸和高锰酸钾(氯酸钾或重铬酸钾)之间无条件的反应产物是氯气,但是金属铝易被氧气氧化而变质,所以点燃D处酒精灯之前需排除装置中的空气;
(2)金属钠和氢气之间化合可以得NaH,但是氢气中的氯化氢要除去,金属钠和氧气加热下会产生过氧化钠杂质,据此回答;
(3)由反应原理得,测定铝氢化钠样品的纯度即通过测定铝氢化钠与水反应生成的氢气的量计算铝氢化钠的量,从而计算其纯度.
解答 解:(1)氯化铝的制备是金属铝和氯气之间反应的产物,则装置A为制备氯气的发生装置,浓盐酸和高锰酸钾(氯酸钾或重铬酸钾)之间无条件的反应产物是氯气,所以A中所盛装的试剂的名称为高锰酸钾(氯酸钾或重铬酸钾),
故答案为:高锰酸钾(氯酸钾或重铬酸钾);
(2)制取NaH则用金属钠和氢气化合可以得到,所以A装置为氢气的发生装置,B为除去氢气中的HCl气体,所以用氢氧化钠溶液,而原来是除去氯气中的HCl用的是饱和食盐水;又由于装置中会有空气残留,所以金属钠和氧气加热下会产生过氧化钠杂质,再加上有钠剩余,则如果操作不当,制得的NaH中可能含有Na、Na2O2,
故答案为:氢氧化钠溶液;Na、Na2O2;
(3)由反应原理得,测定铝氢化钠样品的纯度即通过测定铝氢化钠与水反应生成的氢气的量计算铝氢化钠的量,从而计算其纯度,所以从简约性、准确性考虑,最甲没有使用恒压漏斗,测出的氢气有误差;C、D采用排水法收集氢气,由于导管中会有残留,导致测出的氢气有误差,适宜的方案是乙;通过连续两次读数的氢气体积相等,说明铝氢化钠与水完全反应,冷却至室温,
故答案为:乙;连续两次读数的氢气体积相等.
点评 本题考查知识点较多,涉及方程式的书写、装置图的选择、物质的制备和除杂等元素化合物的性质,属于拼合型题目,需要学生具备扎实的基础,难度中等.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有脱水性,因此实验室可用浓硫酸与浓盐酸制取少量HCl气体 | |
| B. | 钠是活泼金属,可用电解NaCl溶液的方法获得金属钠 | |
| C. | 碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污 | |
| D. | 在电热水器的钢铁内胆中装入铜棒可以防止内胆被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三溴化铝溶液 | B. | 偏铝酸钠溶液 | C. | 明矾溶液 | D. | 硝酸铝溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L CCl4中含有的分子数为0.5NA | |
| B. | 在Na2O2与水的反应中,每生成1 mol O2,转移电子的数为2NA | |
| C. | 常温常压下,7.8 g苯中含有双键的数目为0.3NA | |
| D. | 25℃时,0.1 mol•L-1 NH4NO3溶液中含有的铵根离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
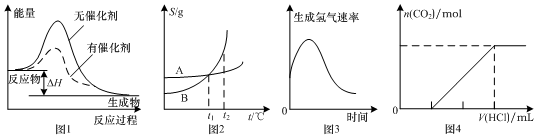
| A. | 图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| C. | 图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应 | |
| D. | 图4表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1 mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Ⅰ、Ⅱ装置之间缺少干燥装置 | B. | Ⅱ装置中玻璃管内有水冷凝 | ||
| C. | Ⅱ装置中CuO没有全部被还原 | D. | Ⅲ装置后缺少干燥装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com