
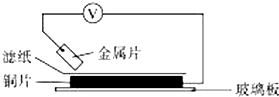
 将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表.已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请依据记录数据判断,下列有关说法正确的是( )
将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表.已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请依据记录数据判断,下列有关说法正确的是( )| 金属 | 电子流动方向 | 电压/V |
| A | A→Cu | +0.78 |
| B | Cu→B | +0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
| A. | 在四种金属中C的还原性最弱 | |
| B. | 金属B能从硫酸铜溶液中置换出铜 | |
| C. | AD若形成原电池时A为正极 | |
| D. | AB形成合金时,将该合金露置在空气中,A先被腐蚀 |
分析 形成原电池反应时,活泼金属为负极,电子由负极经外电路流向正极,由电子流向可知A、C、D的活泼性比Cu强,B的活泼性比Cu弱,由题给信息“构成两电极的金属其金属活泼性相差越大,电压表的读数越大”可知活泼性为C>A>D>Cu>B,以此解答.
解答 解:由电子流向可知A、C、D的活泼性比Cu强,B的活泼性比Cu弱,由题给信息“构成两电极的金属其金属活泼性相差越大,电压表的读数越大”可知活泼性为C>A>D>Cu>B,
A.在四种金属中C的还原性最强,故A错误;
B.活泼性铜大于B,则金属铜能置换出B,故B错误;
C.AD若形成原电池时,A为负极,D为正极,故C错误;
D.活泼性A大于B,则A、B形成合金时,将该合金露置在空气中,A先被腐蚀,故D正确.
故选D.
点评 本题考查原电池知识,侧重于学生的分析能力的考查,为高考高频考点,注意根据题给信息解答该题,仔细审题,加强审题能力的培养,把握金属的活泼性强弱,为解答该题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Mg2+、SO42-、NO3- | B. | Na+、Ag+、Br-、PO43- | ||
| C. | Ba2+、K+、SO32-、ClO- | D. | Al3+、NH4+、CO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、NH4+、SO42-、NO3- | B. | OH-、K+、NH4+、Cl- | ||
| C. | Fe3+、Cl-、Na+、OH- | D. | Fe2+、H+、SO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应是放热反应,升高温度,正反应速率增大 | |
| B. | 往容器中通入稀有气体He,由于压强增大,所以反应速率增大 | |
| C. | 往容器中加入少量A,反应速率增大 | |
| D. | 当容器内的压强不再变化,可以判断反应已经达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

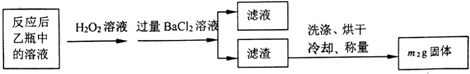
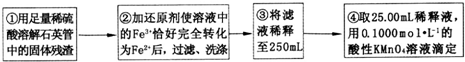
| 试验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KmnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的原子序数越大,原子半径越大 | |
| B. | 同族元素相差的原子序数可能为16、26、36、46 | |
| C. | I A族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 碱金属单质的熔点、沸点均随着原子序数的递增而升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com