
| A. | 钙 | B. | 铜 | C. | 溴 | D. | 铯 |
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:解答题
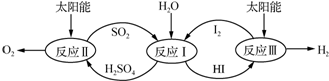
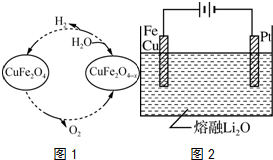
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
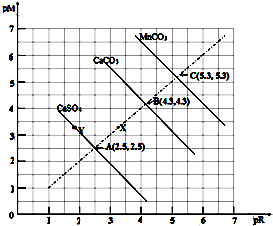
| A. | MnCO3在常温下的Ksp=2.5 x10-11(已知100.4=2.5) | |
| B. | 三种物质在常温下的溶解度大小顺序为MnCO3>CaCO3>CaSO4 | |
| C. | 处于Y点的CaSO4溶液中c(Ca2+)>c(SO42-) | |
| D. | Ca2+、CO32-浓度为X点的溶液可通过蒸发溶剂变为B点的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 压强/MPa C% 速度/℃ | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
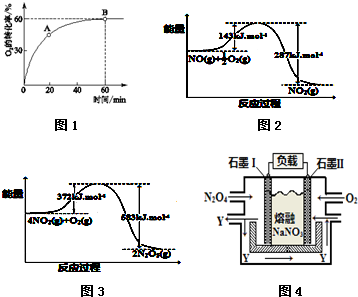
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
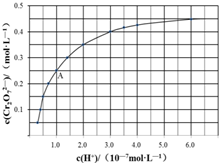 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
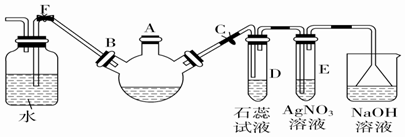
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com