
 (1)电子表中的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.请回答:
(1)电子表中的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.请回答:分析 (1)根据化合价变化可知Zn被氧化,应为原电池的负极,则正极为Ag2O,根据电极反应判断溶液PH的判断,根据电极反应式计算;
(2)氢氧燃料电池中,氧气在正极得电子,在碱性电解质环境下氢气失电子生成水,电池总反应式表示为:2H2+O2=2H2O;
(3)a、根据氮气的变化量求出氨气的变化量,再求反应速率;
b、利用三段式求出平衡时各反应物的物质的量,再求出氨气的含量;
c、当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变;
(4)根据烷烃的通式CnH2n+2来计算;烷烃在空气中燃烧的生成二氧化碳和水;根据烷烃同分异构体书写解答.
解答 解:(1)已知总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag,则正极为Ag2O,Ag2O得电子生成Ag,则正极反应式为:Ag2O+H2O+2e-═2Ag+2OH-;负极电极反应为Zn+2OH-=ZnO+H2O+2e-,消耗氢氧根离子,溶液的pH减小,当 6.5g Zn 完全溶解时,参加反应的Zn的物质的量为0.1mol,则转移的电子为0.2mol;
故答案为:Ag2O+H2O+2e-=2Ag+2OH-;减小;0.2;
(2)氢氧燃料电池中,氧气在正极得电子,则O2从正极通入,在碱性电解质环境下氢气在负极失电子生成水,则负极的电极反应为2H2-4e-+4OH-=4H2O,电池总反应式表示为:2H2+O2=2H2O,所以反应后溶液的体积增大,氢氧化钠的浓度减小;
故答案为:正;2H2-4e-+4OH-=4H2O;变小;
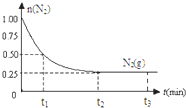
(3)a、从开始反应到t1时刻,氮气的变化量为0.5mol,则生成氨气为1mol,所以v(NH3)=$\frac{\frac{1mol}{2L}}{{t}_{1}min}$=$\frac{0.5}{t{\;}_{1}}$mol/(L•min),
故答案为:$\frac{0.5}{t{\;}_{1}}$mol/(L•min);
b、N2(g)+3H2(g)?2NH3(g),
起始量(mol):1 3 0
反应量(mol):0.75 2.25 1.5
平衡量(mol):0.25 0.75 1.5
则平衡时气体总物质的量为0.25+0.75+1.5=2.5mol,则氨气在反应混合物中的百分含量是$\frac{1.5mol}{2.5mol}$×100%=60%;
故答案为:60%;
c、A.一个N≡N键断裂表示正速率,有6个N-H键断裂表示逆速率,而且正逆反应速率之比等于计量数比,故A正确;
B.容器的体积不变,气体的质量守恒,所以密度始终不变,则不能用密度来判断平衡,故B错误;
C.随着反应进行,气体的物质的量减少,气体的总质量不变,则混合气体的平均相对分子质量逐渐增大,当平均相对分子质量不再改变即是平衡状态,故C正确;
D.正反应速率v(H2)=0.6mol/(L•min),逆反应速率v(NH3)=0.2mol/(L•min),正逆速率之比不等于计量数之比,所以不能判断平衡状态,故D错误;
故答案为:AC;
(4)设烷烃的分子式为CxH(2x+2),
则14x+2=72,解得x=5,
所以该烷烃的分子式为C5H12,
分子式为C5H12的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH3,
主链有4个碳原子的:CH3CH(CH3)CH2CH3,
主链有3个碳原子的:CH3C(CH3)2CH3;
故答案为:C5H12;C5H12+8O2$\stackrel{点燃}{→}$5CO2+6H2O;CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、CH3C(CH3)2CH3.
点评 本题考查了原电池原理的应用、反应速率的求算、平衡状态的判断、烷烃分子式的判断、同分异构体等,题目涉及的知识点较多,侧重于考查学生对所学知识的综合应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水:Na+H2O=Na++OH-+H2↑ | |
| B. | 铜与浓硫酸:Cu+2H+=Cu2++H2↑ | |
| C. | 氯气与氢氧化钠溶液:Cl2+OH-=Cl-+H2O | |
| D. | 二氧化硅与氢氧化钠溶液:SiO2+2OH-=SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该化合物所含化学键为共价键和离子键.
,该化合物所含化学键为共价键和离子键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HIO4>HBrO4 | B. | 原子半径大小 Na>S>O | ||
| C. | 碱性强弱KOH>NaOH | D. | 金属性强弱Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性 | B. | 还原性 | ||
| C. | 既有氧化性,又有还原性 | D. | 既无氧化性,也无作还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂能加快NH3转化为NO | |
| B. | 加压有利于N2与H2反应生成NH3 | |
| C. | 往醋酸溶液中加少量碱,有利于CH3COO-的增多 | |
| D. | 配制FeCl3溶液时,向溶液中加入少量盐酸 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高一阶段考一化学卷(解析版) 题型:选择题
NA为阿伏伽德罗常数的值,下列叙述错误的是( )
A.18 g H2O中含的 质子数为10 NA
质子数为10 NA
B.12 g  金刚石含有的电子数为4 NA
金刚石含有的电子数为4 NA
C.46 g NO2和N2O4混合气体中含有原子总数为3 NA
D.23 g Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com