
| A. | 加H2O | B. | 通入CO2 | C. | 通入SO2 | D. | 加少量NaOH |
分析 漂白粉在溶液中存在下列平衡:ClO-+H2O?HClO+OH-,若提高其漂白性能,则HClO的浓度增大,平衡正向移动,据此分析.
解答 解:A.加水稀释,HClO浓度降低,不能提高其漂白效率,故A错误;
B.通入CO2,消耗氢氧根离子,则平衡正向移动,HClO的浓度增大,能提高其漂白效率,故B正确;
C.通入SO2,与HClO反应,则HClO浓度降低,不能提高其漂白效率,故C错误;
D.加少量NaOH,平衡:ClO-+H2O?HClO+OH-,逆向移动,则HClO的浓度减小,不能提高其漂白效率,故D错误;
故选B.
点评 本题考查了盐的水解平衡移动,题目难度不大,可以根据平衡移动原理进行判断,试题有利于培养学生灵活应用所学知识的能力.


 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂能加快反应速率 | |
| B. | 增大压强能减慢反应速率 | |
| C. | 达到平衡时,反应速率:v(正)=v(逆)=0 | |
| D. | 达到平衡时,N2和H2能100%转化为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S2O3+2HCl═2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 | |
| B. | 若在恒容容器中发生反应:N2+3H2?2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 | |
| C. | 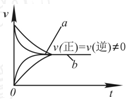 在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率-时间图象可用图表示 | |
| D. | 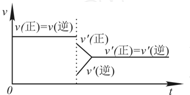 若在恒压容器中发生反应:2SO3?2SO2+O2,达到平衡后再充入适量He,其速率-时间图象可用图表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
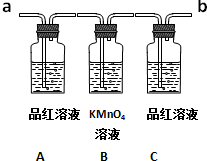 已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4用如图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2
已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4用如图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 有机物X的分子式为Cl2H15O | |
| B. | X分子不能使酸性高锰酸钾溶液褪色 | |
| C. | X分子中一定在同一个平面内的碳原子最多6个 | |
| D. | 在Ni作催化剂的条件下,1molX最多能与4molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有吸附性 | |
| B. | 溶解度大于CuS、PbS、CdS | |
| C. | 溶解度小于CuS、PbS、CdS | |
| D. | MnO2的氧化性强于Cu2+、Pb2+、Cd2+等金属离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com