
| A. | 3,4,4-三甲基己烷 | B. | 2,2-二甲基戊烷 | ||
| C. | 2-甲基-3-戊炔 | D. | 2-甲基-4-乙基戊烷 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A.3,4,4-三甲基己烷,该命名不满足取代基编号之和最小,说明编号方向错误,该有机物正确命名为:3,3,4-三甲基己烷,故A错误;
B.2,2-二甲基戊烷,该命名满足有机物命名原则,故B正确;
C.从距离官能团近的一端命名,应为4-甲基-2-戊炔,故C错误;
D.2-甲基-4-乙基戊烷,选取的主链不是最长碳链,该有机物最长碳链含有6个C,主链为己烷,其正确命名为:2,4-二甲基己烷,故D错误.
故选B.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性知识的考查,侧重对学生基础知识的检验和训练.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,所含的化学键类型为离子键、共价键.
,所含的化学键类型为离子键、共价键. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2O、MgO、CaO | B. | MgO、CaO、K2O | C. | MgO、K2O、CaO | D. | CaO、K2O、MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因反应太剧烈,可用分液漏斗控制滴水速度来控制反应速度 | |
| B. | 为了得到比较平缓的乙炔气流,可用饱和食盐水代替水 | |
| C. | 乙炔气体中混有PH3和H2S等杂质,可用硫酸铜溶液将其除去 | |
| D. | 为控制反应的速率,可用碳化钙粉末和饱和食盐水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
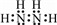 .
. ,N采用sp3杂化方式,粒子空间构型为V型.
,N采用sp3杂化方式,粒子空间构型为V型.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2升华 | B. | NaCl颗粒被粉碎 | ||
| C. | 溴蒸汽被木炭吸附 | D. | 从NH4HCO3中闻到了刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用铝制容器盛装浓硫酸,说明常温下铝和浓硫酸不反应 | |
| B. | 在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si | |
| C. | 在空气中加热铝箔,发现内部的铝熔化但不滴落,说明铝不易与氧气反应 | |
| D. | 向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com