
【题目】(1)在标准状况下,4.48LCH4和CO2的混合气体质量为6.0g,则该混合气体的平均摩尔质量为____,其中CH4和CO2的物质的量之比为____。
(2)将17.1gBa(OH)2溶解在水中,配成100mL溶液,配好后从中取出10mL溶液,加水稀释至100mL,则稀释后所得溶液中OH-的物质的量浓度是__________mol/L。
(3)在标准状况下,VL某气体(摩尔质量为Mg/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=______mol/L(用以上字母表示,且必须化简)。
(4)ZnSO4溶液中含有少量Fe2+,为了除去这种离子,调节溶液的pH为5,然后加入高锰酸钾溶液,使之生成沉淀。已知高锰酸钾的还原产物是MnO2,则该反应的离子方程式为__________。
【答案】30g/mol 1:1 0.2mol/L ![]() MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+
MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+
【解析】
(1)根据n=V/Vm、M=m/n以及十字交叉法分析解答;
(2)根据n=m/M、c=n/V以及稀释过程中溶质的物质的量不变分析解答;
(3)根据n=V/Vm、c=n/V结合溶液的密度分析解答;
(4)根据电子得失守恒书写反应的离子方程式。
(1)在标准状况下,4.48LCH4和CO2的混合气体质量为6.0g,物质的量是4.48L÷22.4L/mol=0.2mol,则该混合气体的平均摩尔质量为6.0g÷0.2mol=30g/mol,根据十字交叉法可知CH4和CO2的物质的量之比为![]() ;
;
(2)17.1gBa(OH)2的物质的量是17.1g÷171g/mol=0.1mol,溶解在水中,配成100mL溶液,其物质的量浓度是0.1mol÷0.1L=1.0mol/L。配好后从中取出10mL溶液,加水稀释至100mL,即稀释了10倍,由于稀释过程中溶质的物质的量不变,则稀释后所得溶液中氢氧化钡的浓度是1.0mol/L÷10=0.1mol/L。由于氢氧化钡是二元强碱,则稀释后溶液中OH-的物质的量浓度是0.1mol/L×2=0.2mol/L;
(3)在标准状况下,VL某气体(摩尔质量为Mg/mol)溶解在1L水(水的密度近似为1g/cm3)中,气体的物质的量是![]() ,质量是
,质量是![]() ,则溶液质量是1000g+
,则溶液质量是1000g+![]() 。假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的体积是
。假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的体积是![]() ,所以物质的量浓度c=
,所以物质的量浓度c=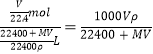 mol/L;
mol/L;
(4)ZnSO4溶液中含有少量Fe2+,为了除去这种离子,调节溶液的pH为5,然后加入高锰酸钾溶液,使之生成沉淀,沉淀是氢氧化铁。已知高锰酸钾的还原产物是MnO2,即Mn元素化合价从+7价降低到+4价得到3个电子,Fe元素化合价从+2价升高到+3价,失去1个电子,所以根据电子得失守恒、原子守恒以及电荷守恒可知该反应的离子方程式为MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. s能级的能量一定比p能级低 B. 电子云图中小黑点多的区域表示电子多
C. 3p2表示第三能层上有两个电子 D. 同一原子中,2p、3p、4p能级的轨道数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答下列问题:

(1)元素③形成的单质的电子式为_________;元素②形成的最高价氧化物的结构式为________。
(2)②、③、④、⑤元素形成的氢化物中,热稳定性最强的是_________(填化学式),沸点最高的是__________(填化学式)。
(3)元素⑩在周期表中的位置_________;该元素的单质主要用途________(填一种)。
(4)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较__________(填化学式)。
(5)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为___________。
(6)用电子式表示⑥、⑧两元素结合成化合物的形成过程__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组物质中含有的化学键类型完全相同的是
A.NaCl、HCl、NaOHB.Na2S、H2O2、H2O
C.Ar、H2SO4、SO2D.HBr、CO2、SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物的用途非常广泛,回答下列问题:
(1)基态铜原子有种不同运动状态的电子,二价铜离子的电子排布式为________。
(2)铜能与类卤素(CN)2反应生成Cu(CN)2 1mol(CN)2分子中含有π键的数目为___________。
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写),结构如图所示,
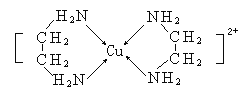
则Cu2+的配位数为_________,该配离子中所含的非金属元素的电负性由大到小的顺序是________;乙二胺分子中氮原子轨道的杂化类型为______,乙二胺和三甲胺[N(CH3)3]均属于胺,但相对分子质量相近,但乙二胺比三甲胺的沸点高的多,原因是__________。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子数目为________。
(5)某M原子的外围电子排布是为3s23p5,铜与M形成化合物的晶胞如图所示(黑球代表铜原子)。
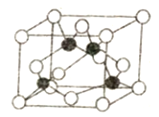
①已知铜和M的电负性分别为1.9和3.0,则铜与M形成的该种化合物属于________ (填“离子”或“共价”)化合物。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为______pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)是一种无色的可燃液体。请回答下列问题:
(1)联氨是火箭的重要燃料。已知:
(a) N2H4(l)的燃烧热ΔH1 = –624.0 kJmol–1
(b) ![]() ΔH2 = –66.4 kJmol–1
ΔH2 = –66.4 kJmol–1
(c) ![]() ΔH3 = –28.6 kJmol–1
ΔH3 = –28.6 kJmol–1
写出N2H4(l)在N2O4(g)中燃烧生成氮气和液态水的热化学方程式________________。
(2)N2H4能使锅炉内壁的铁锈(主要成分为Fe2O3xH2O)变成磁性氧化铁,从而可减缓锅炉锈蚀。反应过程中每生成0.1 mol磁性氧化铁,转移的电子数为_________________。
(3)联氨-空气燃料电池的电解质为KOH溶液。写出该电池放电时负极的反应式________。
(4)联氨的制备方法有多种,尿素法是其中之一。在KMnO4的催化作用下,尿素CO(NH2)2和NaClO、NaOH溶液反应生成联氨、水和两种钠盐,写出该反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:
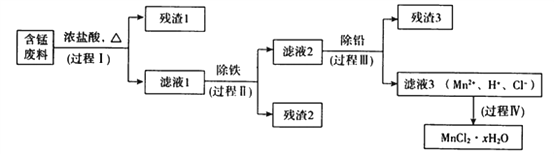
资料a.Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1 mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnOOH与浓盐酸反应的离子方程式是_______________________________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:_________________________________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3+2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.……
写出c的离子方程式:____________________。
(2)过程Ⅱ的目的是除铁。有如下两种方法,
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于5.5。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②两种方法比较,氨水法除铁的缺点是____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是____________。
(4)过程Ⅳ所得固体中的x的测定如下,取m1g样品,置于氯化氢氛围中加热至失去全部结晶水时,质量变为m2g。则x=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.06molFeCl2加入100mLK2Cr2O7溶液中,恰好使溶液中Fe2+全部转化为Fe3+ , Cr2O72﹣还原为Cr3+ . 则K2Cr2O7溶液的物质的量浓度为( )
A.0.05mol/L
B.0.1mol/L
C.0.2mol/L
D.0.3mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com