
 砷(33As)在元素周期表中与氮同主族,砷及其化合物被运用在农药、防腐剂、染料和医药等领域,及其多种合金中.
砷(33As)在元素周期表中与氮同主族,砷及其化合物被运用在农药、防腐剂、染料和医药等领域,及其多种合金中.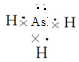 .
.分析 (1)As的原子序数为33,根据能量最低原理书写电子排布式,根据砷核外电子排布式判断原子次外层上的电子数;AsH3的电子式书写不能漏掉一对孤对电子对;
(2)As2O3是两性偏酸性的氧化物,和酸发生反应生成盐和水,据此书写方程式;
(3)①向亚砷酸溶液中缓缓加入NaOH溶液至pH=11时,生成H2AsO3-,根据电荷守恒和原子守恒解答;
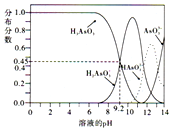
②电离平衡常数为生成物浓度幂之比与反应物浓度幂之积的比值,依据图象中的信息可知,PH=9.2时H3AsO3和H2AsO3-浓度相同;
③H2AsO3-水解大于电离溶液呈碱性;
④HAsO32-中的As显+3价,具有还原性,氯水中的氯气具有氧化性,两者发生氧化还原反应,生成H3AsO4,氯气被还原成氯离子,据此书写离子方程式.
解答 解:(1)As的原子序数为33,基态原子的电子排布式为1s22s22p63s23p63d104s24p3,次外层为3s23p63d10,所以砷原子次外层上的电子数为18,AsH3的结构中3个H原子和As原子间形成3条共价键,电子式为: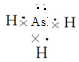 ,
,
故答案为:18;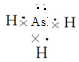 ;
;
(2)砒霜(As2O3)是两性偏酸性的氧化物,和酸反应体现碱性氧化物的性质,和盐酸反应生成AsCl3、H2O,反应方程式为:As2O3+6HCl=2AsCl3+3H2O,
故答案为:As2O3+6HCl=2AsCl3+3H2O;
(3)①根据各微粒的分布分数与溶液pH的关系图可知,pH=11时,生成H2AsO3-,所以向亚砷酸溶液中缓缓加入NaOH溶液至pH=11时,离子方程式为:H3AsO3+OH-=H2AsO3-+H2O,
故答案为:H3AsO3+OH-=H2AsO3-+H2O;
②电离平衡常数为生成物浓度幂之比与反应物浓度幂之积的比值,H3AsO3的第一级电离方程式为H3AsO3?H++H2AsO3-,图象中pH=9.2时,H3AsO3和H2AsO3-浓度相同,K=$\frac{C({H}^{+})•C({H}_{2}{A}_{S}{{O}_{3}}^{-})}{C({H}_{3}{A}_{S}{O}_{3})}$=10-9.2,
故答案为:10-9.2;
③Na2HAsO3溶液呈碱性,说明H2AsO3-以水解为主,所以该溶液中c(H2AsO3-)>c(AsO33-),
故答案为:>;
④HAsO32-中的As显+3价,具有还原性,氯水中的氯气具有氧化性,两者发生氧化还原反应,As(+3→+5),Cl(0→-1),根据得失电子守恒和原子守恒,离子方程式为:HAsO32-+H2O+Cl2=H3AsO4+2Cl-,
故答案为:HAsO32-+H2O+Cl2=H3AsO4+2Cl-.
点评 本题考查较为综合,主要是原子核外电子排布、电子式、氧化还原反应、水解等知识点,侧重分析与应用能力的考查,注意有关平衡常数的计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
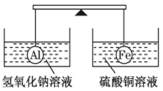 在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在氢氧化钠溶液和硫酸铜溶液中片刻,则下列说法正确的是( )
在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在氢氧化钠溶液和硫酸铜溶液中片刻,则下列说法正确的是( )| A. | 两烧杯中均无气泡产生 | B. | 去掉两烧杯,杠杆右端下沉 | ||
| C. | 去掉两烧杯,杠杆仍平衡 | D. | 左边烧杯中的溶液质量减少了 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数相同的微粒,其核外电子排布也相同 | |
| B. | 质量数相同的原子,其化学性质不一定相同 | |
| C. | 金属性越活泼,其原子在反应中越易失去电子 | |
| D. | 非金属性越活泼,其阴离子越难失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)<2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 若c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),则一定a>0.5 | |
| D. | 若c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3),则可确定a=0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.4g白磷(P4)中所包含的P-P共价键有0.6NA | |
| B. | 40 g SiC晶体中含有NA个SiC分子 | |
| C. | 1mol淀粉(C6H10O5)n水解后产生葡萄糖的分子数一定为NA | |
| D. | 标准状况下,2molNa2O2与44.8LSO2反应,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验操作 | 用玻璃棒蘸取次氯酸钠溶液,点滴在干燥的pH试纸上 | 向AgCl悬浊液中滴加稀Na2S溶液 | 将粗苯甲酸中加水,加热,使其充分溶解后,再加少量水,然后,趁热过滤,滤液静置,缓慢冷却结晶,滤出晶体. | 混有少量乙烯的乙烷气体通入到酸性高锰酸钾溶液中 |
| 实验目的 | 证明次氯酸是弱酸 | 同温下Ksp(AgCl)大于Ksp(Ag2S) | 重结晶法提纯苯甲酸 | 除去乙烷中混有的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
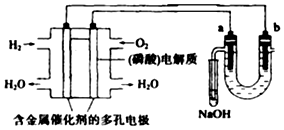 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )| A. | 电池工作时,正极反应式为:O2+4H++4e-═2H2O | |
| B. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| C. | 试管中NaOH溶液仅用来吸收电解时产生的Cl2 | |
| D. | 当电池中消耗2.24L(标准状况)H2时,b极周围会产生0.02mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com