
| A. | 元素周期表中,电子层数越多,半径一定越大 | |
| B. | 元素周期表中,同一主族,随着核电荷数的递增,熔沸点逐渐降低 | |
| C. | 非金属元素与非金属元素之间可能形成离子键 | |
| D. | 含有离子键的物质一定是离子化合物,只含共价键的物质一定是共价化合物 |
分析 A.电子层数多,原子半径不一定大,如原子半径Li>Cl;
B.同一族元素从上到下,金属单质的熔点递减,非金属单质形成分子晶体的熔点递增;
C.非金属元素与非金属元素之间可能形成离子键,如铵盐;
D.只含共价键的物质可以是单质.
解答 解:A.电子层数、核电荷数会影响原子半径,电子层数多,原子半径不一定大,如原子半径Li>Cl,故A错误;
B.同一族元素从上到下,金属单质的熔点递减,非金属单质形成分子晶体的熔点递增,故C错误;
C.非金属元素与非金属元素之间可能形成离子键,如铵盐,故C正确;
D.含有离子键的物质一定是离子化合物,但只含共价键的物质可以是单质,不一定是化合物,故D错误,
故选C.
点评 本题考查元素周期律应用、离子化合物与共价化合物、化学键等,难度不大,注意利用列举法解答.


科目:高中化学 来源: 题型:多选题
 S-诱抗素是植物生长的平衡因子,咖啡酸乙酯具有抗肿瘤活性动,两者的结构如图所示.下列说法中不正确的是( )
S-诱抗素是植物生长的平衡因子,咖啡酸乙酯具有抗肿瘤活性动,两者的结构如图所示.下列说法中不正确的是( )| A. | S-诱抗素核磁共振氢谱图中有11组峰 | |
| B. | 咖啡酸乙脂能使酸性KMnO4溶液褪色 | |
| C. | 两者都不能与金属钠反应放出氢气 | |
| D. | 两者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 铅蓄电池是可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,下列说法正确的是( )
铅蓄电池是可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,下列说法正确的是( )| A. | 放电时,电解质溶液中H2SO4的浓度将变大 | |
| B. | 放电时,正极反应式为:Pb+SO42--2e-=PbSO4 | |
| C. | 放电后用如图所示装置充电,电解质溶液中H+移向左边(PbO2极) | |
| D. | 用如图所示装置充电,阳极反应式为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某种有机物由C、H、O三种元素组成,其分子球棍模型如图所示,下列有关叙述正确的是( )
某种有机物由C、H、O三种元素组成,其分子球棍模型如图所示,下列有关叙述正确的是( )| A. | ①②④⑥ | B. | ②③⑤⑥ | C. | ②④⑦⑧ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
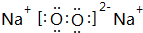 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +(n-18) | B. | -n | C. | -(n+18) | D. | +(18-n) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2molSO2、0.1 molO2,1.8molSO3,达到新平衡时SO3转化率升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com