
| A. | MgCl2→Mg(OH)2 | B. | Fe3+→Fe2+ | C. | HNO3→NO | D. | Cl-→Cl2 |
科目:高中化学 来源: 题型:选择题
| A. | 在已知碱金属元素中具有最大的原子半径 | |
| B. | 其氧化物对应的水化物是极强的碱 | |
| C. | 在空气中燃烧时生成氧化物Fr2O | |
| D. | 在已知碱金属元素单质中熔点最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
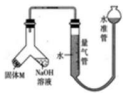 某课外兴趣小组为探究某种铝合金(合金元素为 Mg、Al)是否符合国家质量标准(国 家规定其中铝含量不能低于 78%),设计如图所示装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为 Mg、Al)是否符合国家质量标准(国 家规定其中铝含量不能低于 78%),设计如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 波长最长 | B. | 波长最短 | C. | 平均波长 | D. | 中间波长 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯的结构简式为:CH3COOCH2CH3 | |
| B. | CH4分子的球棍模型 | |
| C. | 甲苯的化学式:C7H8 | |
| D. | 环丙烷的键线式为: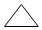 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛.
氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PX 的结构简式为: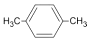 | |
| B. | PX 的同分异构体有 2 种(不包含自身) | |
| C. | PX 能发生取代反应和加成反应 | |
| D. | PX 不能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com