
| A. | Fe2+ | B. | NH4+ | C. | Al3+ | D. | Na+ |
分析 加入氢氧化钠溶液后,铵根离子、铝离子、亚铁离子分别与氢氧化钠反应生成一水合氨、偏铝酸钠、氢氧化亚铁,加热后一水合氨转化成氨气、氢氧化亚铁转化成氢氧化铁;然后加入盐酸后偏铝酸钠转化成铝离子,氢氧化铁转化成氯化铁,所以离子数目基本不变为铝离子.
解答 解:向含有Na+、NH4+、Al3+、Fe2+的溶液中,加入足量的NaOH溶液以后,Na+数目增大,NH4+、Al3+、Fe2+分别与氢氧化钠反应生成一水合氨、偏铝酸钠、氢氧化亚铁,加热后一水合氨转化成氨气、氢氧化亚铁转化成氢氧化铁,
再加入足量的盐酸,氢氧化铁转化成Fe3+,偏铝酸钠转化成Al3+,
所以反应前后溶液中离子的数目保持不变的只有Al3+,
故选C.
点评 本题考查离子共存的判断、离子反应的应用,为高考的高频题,题目难度中等,明确常见离子的性质及离子反应发生条件为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水中含有的分子数是NA个 | |
| B. | 32g氧气中含有的分子数为NA | |
| C. | 1mol氯气与足量的氢氧化钠溶液反应,转移的电子数为2NA | |
| D. | 1L1mol/LCaCl2溶液中含有的氯离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钠与水反应:Na2O+H2O═Na++OH- | |
| B. | 氯化铝溶液与足量氨水反应:Al3++4OH-═AlO2-+2H2O | |
| C. | 氯化铝溶液与足量NaOH溶液反应:Al3++3OH-═Al(OH)3↓ | |
| D. | 氧化铝和适量的烧碱溶液反应:Al2O3+2OH-═2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 盐酸 | 50mL | 50mL | 50mL |
| m(混合物) | 9.2g | 14.2g | 27.6g |
| V(CO2)(标准状况) | 2.2L | 3.36L | 3.36L |
| A. | 混合物中NaHCO3、KHCO的物质的量之比为1:2 | |
| B. | 当混合物质量为14.2g时,50mL盐酸恰好完全反应 | |
| C. | 盐酸的物质的量浓度为3.0mol/L | |
| D. | 9.2g混合物加热,固体质量减少2.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入先加氯水,再加KSCN溶液后显红色,该溶液中一定含Fe2+ | |
| B. | 向某溶液中加入硝酸酸化的硝酸银溶液,出现白色沉淀,该溶液中一定含Cl- | |
| C. | 向某溶液中加入盐酸酸化的氯化钡溶液,出现白色沉淀,该溶液中一定含SO42- | |
| D. | 向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液中一定含CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 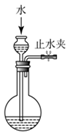 检查装置气密性 | |
| B. |  实验室制氨气 | |
| C. | 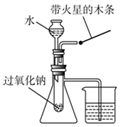 验证过氧化钠与水反应即生成氧气又放热 | |
| D. |  分离苯和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
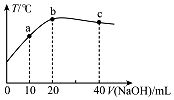 在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )| A. | 若a点溶液呈酸性,则a点有:c(CH3COO-)>c(Na+)>c(CH3COOH) | |
| B. | 从b到c:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | 水的电离程度:b点<c点 | |
| D. | b点有0.01000mol•L-1+c(H+)=c(Na+)-c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
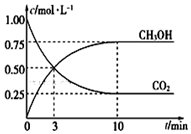 根据现代工业技术可以用H2和CO反应来生产燃料甲醇,其反应方程式如下:CO2 (g)+3H2(g)?H2O(l)+CH3OH(g)△H=-49.00kJ•mol-1
根据现代工业技术可以用H2和CO反应来生产燃料甲醇,其反应方程式如下:CO2 (g)+3H2(g)?H2O(l)+CH3OH(g)△H=-49.00kJ•mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com