
 .
.| 元素符号 | 电子排布式 | 价层电子排布 | 在周期表中的位置 |
| ① | 1s22s22p6 | ② | ③ |
| Cr | ④ | ⑤ | ⑥ |
分析 (1)配合物中中心原子提供空轨道,配体提供孤电子对;配位键由提供孤电子对的原子指向提供空轨道的原子;
(2)由第二周期元素为中心原子,通过SP3杂化形成中性分子,如果该分子为正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,如果是三角锥型分子,则该分子中价层电子对个数是4且含有一个孤电子对,如果是V型分子,则该分子中价层电子对个数是4且具有2个孤电子对;
(3)根据元素原子原子序数等于核外电子数,结合能量最低原理书写核外电子排布式,周期数等于原子核外电子层数,族等于最外层电子数.
解答 解:(1)在配合物离子[Fe(SCN)]2+中,中心离子是Fe3+,提供提供空轨道接受孤对电子,配合物离子[Cu(NH3)4]2+中的配位键为 ,
,
故答案为:Fe3+; ;
;
(2)由第二周期元素为中心原子,通过SP3杂化形成中性分子,
如果该分子为正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,该类型分子有:CH4或CF4,
如果是三角锥型分子,则该分子中价层电子对个数是4且含有一个孤电子对,该类型分子有NH3或NF3,
如果是V型分子,则该分子中价层电子对个数是4且具有2个孤电子对,该类型分子有H2O,
故答案为:CH4或CF4;NH3或NF3;H2O;
(3)电子排布式1s22s22p6,由电子排布式可知,原子序数=核外电子数=10,价电子排布式为2s22p6,最大能层数为2,价电子数为8,位于第二周期0族;
故答案为:Ne;2s22p6;第2周期0族;
Cr是24号元素,根据核外电子排布规律可知,电子排布为1s2 2s22p6 3s23p63d5 4s1,原子序数=核外电子数=24,最大能层数为4,价层电子排布为3d54s1,位于第四周期ⅥB族;
故答案为:1s22s22p63s23p63d54s1;3d54s1;第4周期ⅥB族.
点评 本题考查了价层电子对互斥理论、配合物、原子的电子排布式等知识点,根据价层电子对互斥理论确定分子构型、原子杂化方式结合配合物结构特点分析解答本题,注意原子核外电子排布和周期表位置的关系,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl最高正化合价依次升高 | |
| C. | F-、Cl-、Br-还原性依次减弱 | |
| D. | Na、K、Rb的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表中,原子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 室温时,零族元素的单质都是气体 | |
| D. | 位于 IA的元素与位于 VIIA的元素组成的化合物都是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是HF、HCl、HBr、HI.
.共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是HF、HCl、HBr、HI.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产物中只有四氯化碳分子是正四面体结构 | |
| B. | 瓶中气体的黄绿色逐渐变浅,瓶内壁有油状液滴形成 | |
| C. | 若日光直射,可能发生爆炸 | |
| D. | 生成物只有CCl4、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 主族元素的原子核外电子最后填入的能级是s能级 | |
| B. | 主族元素的原子核外电子最后填入的能级是s能级或p能级 | |
| C. | 主族元素的最高正价等于主族的序数 | |
| D. | 主族元素的价电子数有可能超过最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
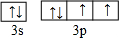 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 维生素C又叫抗坏血酸,是一种水溶性维生素,在空气中及高温下易被氧化.碘单质能将其氧化,其结构如所示.
维生素C又叫抗坏血酸,是一种水溶性维生素,在空气中及高温下易被氧化.碘单质能将其氧化,其结构如所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com