
雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)  N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=_______________________,T1℃时,该反应的平衡常数K=______________________________。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是__________ (填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30 min后升高温度至T2℃,达到平衡时,容器中,NO、N2、CO2的浓度之比为5:3:3,则Q______________ (填“>”、“=”或“<”)0。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:

①由图甲可知,SCR技术中的氧化剂为_______________。已知c(NO2):c(NO)=1:1时脱氮效果最佳,若生成1 mol N2时反应放出的热量为Q kJ。此时对应的脱氮反应的热化学方程式为__________________________。
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为___________________________。
(3)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收。该温度下,吸收液中c(Ca2+)一直保持为0.70 mol·L-1,已知Ksp(CaSO3)=1.4×10-7,求吸收后溶液中的SO32-的浓度_______________。(写出计算过程,结果保留2位有效数字)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某研究性学习小组欲用化学方法测量一个不规则容器的体积。把35.1 g NaCl放入500 mL的烧杯中,加入150 mL蒸馏水。待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释至完全充满容器。从中取出溶液100 mL,该溶液恰好与20 mL 0.100 mol·L-1 AgNO3溶液完全反应。试计算该容器的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液,其中可能存在的离子有:Na+、Ag+、Ba2+、Fe3+、Al3+、AlO2-、
S2-、SO32-、CO32-、SO42-,现取该溶液进行实验,实验结果如下:
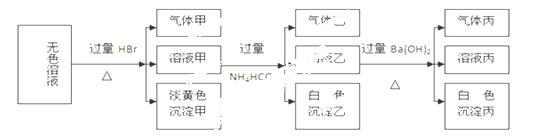
试回答下列问题:
(1)生成沉淀甲的离子方程式为: 。
(2)由溶液甲生成沉淀乙的离子方程式为 。
(3)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表(表中每一行对应正确即可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | |||
| 2 | |||
| 3 | 检验CO2 | 澄清石灰水 | 溶液变浑浊 |
(4)综上所述,该溶液肯定存在的离子有: 。
(5)针对溶液中可能存在的离子,用实验证明是否存在的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用酸性KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。称取1.28 g的粗样品溶于水,用0.40 mol/L的酸性 KMnO4溶液滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
① 滴定终点时的现象是________________________________________________________
② 写出该滴定反应的离子方程式__________________________________________________
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测定结果________(填“偏高”“偏低”或“不变”)
④经计算,产品中Na2S2O3·5H2O的质量分数为 ________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质检验的实验结论正确的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入2滴含[Fe(CN)6]3-溶液,出现蓝色沉淀。 | 该溶液中一定含有Fe2+ |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 某气体能使湿润的蓝色石蕊试纸变红 | 该气体是NH3 |
| D | 将少量某有机物滴加到新制氢氧化铜中,充分振荡,未见砖红色沉淀生成 | 该有机物不含醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
取一小块金属钠放在燃烧匙中加热,下列实验现象描述正确的是( )
①金属钠先熔化 ②在空气中燃烧,产生黄色火焰
③燃烧后得白色固体 ④燃烧后生成淡黄色固体物质
A.①② B.①②③
C.③④ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C三种气体,A是密度最小的气体,B在通常情况下呈黄绿色,纯净的A可以在B中安静地燃烧生成C。把气体B通入到适量石灰乳中可以得到白色浑浊物D。请据此回答下列问题:
(1)写出下列各反应的化学方程式。
①纯净的A在B中安静地燃烧生成C:__________________________;
②将气体B通入到水中:_______________________________________;
③将气体B通入到NaOH溶液中:______________________________;
④将气体B通入到适量石灰乳中:________________________________。
(2)把三种气体分别通入酸性硝酸银溶液中,出现白色沉淀的气体是:________(用字母表示)。
(3)白色浑浊物D因具有漂白性又称为________,该物质在空气中容易变质的原因为(用化学方程式表示)________________ ___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应生成了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com