
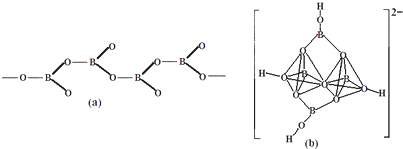
| 1 |
| 2 |
| m |
| V |
| 1 |
| 2 |
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| ||
| V |
| ||
(2
|
8
| ||
| a3?NA |
8
| ||
| a3?NA |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、7.80g Na2O2与5.85g NaCl所含阴离子数相等 |
| B、15g甲醛(HCHO)和乙酸的混合物中氧原子数为0.5NA |
| C、一定条件下,1.4g N2与0.2mol H2混合充分反应,转移的电子数为0.3NA |
| D、常温下,2L pH=12的Na2CO3溶液中含有的OH-数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据物质结构与性质的关系,请回答下列问题:
根据物质结构与性质的关系,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 杯芳烃因其分子形状与希腊圣杯相似而得名,又因可以作为酶模拟物发挥出离子载体、分子识别和包含酶催化活性等特殊功能,而成为人们关注的一个新的研究课题.“对特丁基杯[4]芳烃”的结构如图所示[图中的“+”为(CH3)3C-].试填空:
杯芳烃因其分子形状与希腊圣杯相似而得名,又因可以作为酶模拟物发挥出离子载体、分子识别和包含酶催化活性等特殊功能,而成为人们关注的一个新的研究课题.“对特丁基杯[4]芳烃”的结构如图所示[图中的“+”为(CH3)3C-].试填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| X |
| X |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、教材所示的铜-锌原电池在工作时,H+、Zn2+向铜片附近迁移 |
| B、电解饱和食盐水时,阳极得到Cl2和NaOH(aq) |
| C、电解铝时,电解槽里的负极材料发生氧化反应 |
| D、原电池与电解池连接后,电子从原电池负极流向电解池阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONa+CO2+H2O→CH3COOH+NaHCO3 | ||||
B、CH3COOH+CH318OH
| ||||
C、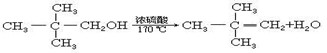 | ||||
D、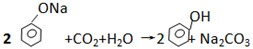 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com