
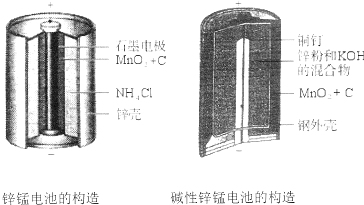
分析 I.(1)二者的不同之处在于固体的表面积不同,反应速率不同;
(2)负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2;
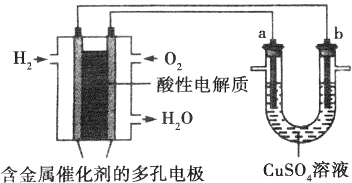
Ⅱ.(1)燃料电池中,正极上通入氧化剂,氧化剂得电子发生还原反应;
(2)U型管有外接电源,属于电解池,a为阳极,b为阴极,根据阳极材料书写电极反应式;
(3)A.电镀时,阴极上析出金属与阳极上溶解金属质量相等,则电解质浓度不变;
B.根据阳极电极材料确定放电的物质;
C.电解精炼时,粗金属作阳极;
D.电子从负极流向阴极.
解答 解:I.(1)二者的不同之处在于固体的表面积不同,碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大,
故答案为:碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大;
(2)负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2,则电极方程式为Zn+2OHˉ-2eˉ=Zn(OH)2,故答案为:Zn+2OHˉ-2eˉ=Zn(OH)2.Ⅱ.(1)左边装置是燃料电池,燃料电池中,通入氧化剂的电极为正极,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
(2)U型管有外接电源,属于电解池,a连接原电池正极,所以为阳极,阳极材料未知导致无法判断失电子的物质,所以不能书写电极反应式,故答案为:阳;不能;因为a电极的电极材料不确定,所以不能写出其电极反应方程式;
(3)A.此装置用于电镀铜时,阳极上铜失电子生成铜离子进入溶液,阴极上铜离子放电生成铜,溶解铜的质量等于析出铜的质量,所以电解一段时间,硫酸铜溶液的浓度不变,故正确;
B.U型管中,a是阳极,但阳极材料未知,无法判断阳极上失电子的物质,故错误;
C.电镀时,粗金属作阳极,纯金属作阴极,若b为纯净金属,a为粗制金属,该装置可用于粗制金属的精炼,故错误;
D.电子经导线流入阴极b电极,故正确;
故选BC.
点评 本题考查了原电池和电解池原理,明确各个电极上发生的反应是解本题关键,注意电解池中,阳极上放电的物质与电极材料有关,如果阳极是活泼金属,则金属材料失电子而不是电解质溶液中阴离子失电子,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CC14振荡后,观察下层液体颜色 | |
| C. | 加入CC14振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生 | |
| D. | 加入CC14振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
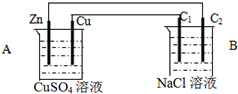 按如图装置进行实验,C1与C2均为石墨棒,回答下列问题
按如图装置进行实验,C1与C2均为石墨棒,回答下列问题 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L苯所含分子数为NA | |
| B. | 1mol甲基所含电子数为10NA | |
| C. | 常温常压下,5.6 g乙烯与丁烯的混合物中含有的氢原子数目为0.8NA | |
| D. | 12 g金刚石中含有C-C键的个数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A. | 7 | B. | 8 | C. | 9 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com