
【题目】(1)实验室常用浓盐酸与高锰酸钾发生反应快速制备少量氯气,该反应的化学方程式为:![]() 用双线桥法表示该反应过程中的电子转移情况______________________,该反应中氧化剂为____________,HCl的作用是______________________。
用双线桥法表示该反应过程中的电子转移情况______________________,该反应中氧化剂为____________,HCl的作用是______________________。
(2)KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的离子方程式是_________________________________。
(3)已知在碱性溶液中可发生如下反应![]() ,则
,则![]() 中R的化合价是________。
中R的化合价是________。
A.+3 B.+4 C.+5 D.+6
(4)填写下列空白:
①等物质的量的CO和CO2中:所含的分子数目之比为_______,相同条件下体积之比为_______,所含的原子总数目之比为_______。
②有下列物质:
a.硫酸 b.盐酸 c.氯气 d.硫酸钡 e.甲烷 f.铜 g.CH3COOH h.氯化氢 i.蔗糖 j.氨气 k.CO2 l.NaHCO3 m.Al(OH)3 n.NaOH溶液
其中属于非电解质的为_____________(填序号,下同。),属于电解质的为____________。
【答案】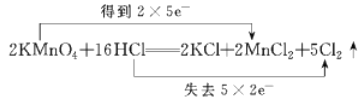 KMnO4 酸和还原剂
KMnO4 酸和还原剂 ![]() D 1:1 1:1 2:3 eijk adghlm
D 1:1 1:1 2:3 eijk adghlm
【解析】
根据化合价变化判断氧化剂、还原剂,用双线桥法分析氧化还原反应;根据题干信息及氧化还原反应原理书写离子方程式;根据电解质及非电解质的概念分析解答。
(1)用双线桥法表示该反应中电子转移情况为: ;Mn元素化合价降低,得电子,作氧化剂,所以氧化剂为KMnO4;HCl中Cl元素化合价有一部分升高为0,有一部分仍为-1,则HCl的作用是 酸和还原剂,故答案为:
;Mn元素化合价降低,得电子,作氧化剂,所以氧化剂为KMnO4;HCl中Cl元素化合价有一部分升高为0,有一部分仍为-1,则HCl的作用是 酸和还原剂,故答案为: ; KMnO4; 酸和还原剂;
; KMnO4; 酸和还原剂;
(2)由KMnO4能与热的经硫酸化的Na2C2O4反应生成Mn2+和CO2,则反应为2KMnO4+5Na2C2O4+8H2SO4![]() K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,离子方式为:
K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,离子方式为:![]() ;
;
(3)根据离子方程式中的电荷守恒得3×1+4×1=3×1+2n,则n=2,所以RO4n为RO42,该离子中O元素化合价为-2价,R、O元素化合价的代数和为-2,所以该离子中R元素化合价=-2-(-2)×4=+6,故答案为:D;
(4)①等物质的量的CO和CO2中,N=NAn,所含的分子数目之比为1:1;相同条件下物质的量之比等于体积之比,所以体积之比为1:1;每个CO分子中含有2个原子,每个CO2分子中含有3个原子,所以原子总数目之比为2:3;
②a.硫酸的水溶液能够导电,硫酸是电解质;
b.盐酸是HCl水溶液,属于混合物,既不是电解质,也不是非电解质;
c.氯气属于单质,既不是电解质,也不是非电解质;
d.硫酸钡是盐,在水溶液中溶解部分完全电离,是强电解质;
e.甲烷是在水溶液中或熔融状态下都不能导电的化合物,属于非电解质;
f.铜是单质,既不是电解质,也不是非电解质;
g.CH3COOH是弱酸,在水溶液里部分电离,属于弱电解质;
h.氯化氢是强酸,在水溶液中完全电离,属于强电解质;
i.蔗糖是在水溶液中或熔融状态下都不能导电的化合物,属于非电解质;
j.氨气是本身无法电离的化合物,属于非电解质;k.CO2本身也无法电离,属于非电解质;l.NaHCO3是盐,在水溶液中完全电离成钠离子和碳酸氢根,属于强电解质;
m.Al(OH)3在水溶液中部分电离,属于弱电解质;
n.NaOH溶液属于混合物,既不是电解质,也不是非电解质,
故属于非电解质的是:eijk,属于电解质的是:adghlm,故答案为:1:1;1:1;2:3;eijk;adghlm。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
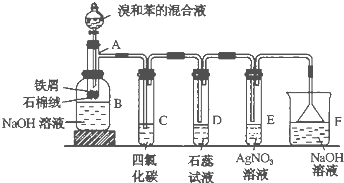
填写下列空白:
①试管A中的反应方程式为______。
②试管C中四氯化碳的作用是:______,反应开始后,观察到D试管中的现象为:___ 。
③在上述整套装置中,具有防倒吸的仪器有______(填字母)。
④反应完毕后,将B瓶中的液体取出,经过_____(填分离操作的名称)可获得粗溴苯,向粗溴苯中加入无水氯化钙,其目的是____。
⑤经以上分离操作后,要进一步提纯粗溴苯,下列操作中必须的是______。
A. 重结晶 B. 过滤 C. 蒸馏 D. 萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述正确的是
A.H2还原CuO的反应只属于还原反应
B.置换反应都是氧化还原反应,所以,![]() 既是置换反应又是氧化还原反应
既是置换反应又是氧化还原反应
C.![]() 是氧化还原反应
是氧化还原反应
D.复分解反应一定不是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是

A. a为直流电源的负极
B. 阴极的电极反应式为2HSO3-+2H++e-=S2O42-+2H2O
C. 阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+
D. 电解时,H+由阴极室通过阳离子交换膜到阳极室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置设计正确、且能达到目的的是

A. 实验I:检查装置的气密性
B. 实验II:测定未知盐酸的浓度
C. 实验III:比较硫、碳、硅三种元素的非金属性强弱
D. 实验IV:定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:

(1)Ti位于元素周期表中的位置为________。钛铁矿在预处理时需要进行粉碎,其原因是_______。
(2)过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________。

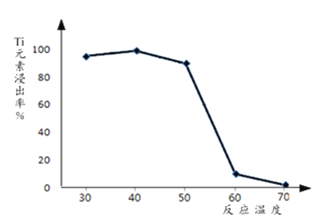
(3)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是___________。
(4)写出由滤液D生成FePO4的离子方程式____________________________________。
(5)由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图所示的装置制备干燥、纯净的氯气。下列有关叙述不正确的是( )
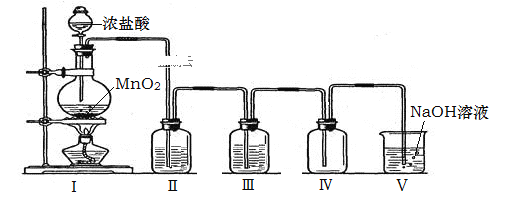
A.本实验操作顺序为:检验装置气密性→添加固体药品→添加液体药品→加热
B.装置Ⅱ、Ⅲ中的试剂依次为浓硫酸、饱和NaCl溶液
C.氯气密度比空气大,故装置Ⅳ中长导管进气,短导管出气
D.装置Ⅴ中反应的离子方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①食醋、②碘化钾淀粉试纸、③淀粉、④白酒,你认为必须选用的物质有_______________(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是______________(填选项字母)。
A.NaClB.NH4ClC.HNO3 D.浓H2SO4
(4)请配平以下化学方程式:Al+NaNO3+NaOH==NaAlO2+N2↑+H2O。若反应过程中转移5mole-,则生成标准状况下N2的体积为_______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com