
| A. | 金属腐蚀的本质是金属原子失去电子而被氧化 | |
| B. | 钢铁吸氧腐蚀的正极反应是:O2+4e-+2H2O=4OH- | |
| C. | 氢氧燃料电池中,氢气在负极发生氧化反应 | |
| D. | 将地下钢管与直流电源的正极相连,用来保护钢管 |
分析 A、金属原子失去电子被氧化;
B、钢铁吸氧腐蚀的正极是氧气发生得电子的还原反应;
C、燃料电池中,燃料在负极发生氧化反应;
D、钢管与直流电源的正极相连,阳极金属易被腐蚀.
解答 解:A、金属腐蚀的本质是金属原子在负极上失去电子而被氧化的过程,故A正确;
B、钢铁吸氧腐蚀的正极是氧气发生得电子的还原反应,电极反应是:O2+4e-+2H2O=4OH-,故B正确;
C、氢氧燃料电池中,在负极上是燃料发生氧化反应的过程,故C正确;
D、将地下钢管与电源负极相连,作电解池的阴极被保护,能防止钢铁锈蚀,故D错误;
故选D.
点评 本题考查学生金属的腐蚀和防护知识以及燃料电池的工作原理知识,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<△H2 | B. | △H3<△H4 | C. | △H5=△H3-△H2 | D. | 2△H5=3△H3-△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类物质的分子都可以用Cm(H2O)n来表示 | |
| B. | 凡能溶于水具有甜味的物质都属于糖类 | |
| C. | 糖类都能发生水解反应 | |
| D. | 糖类是多羟基醛或多羟基酮以及水解能生成它们的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. .
.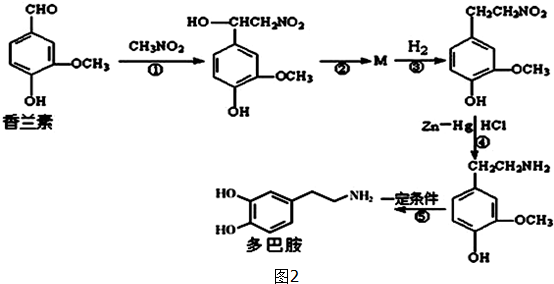
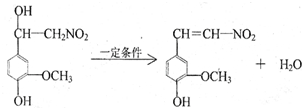 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 14种 | C. | 16种 | D. | 18种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定.当滴定到消耗20mlHCl时所得溶液中离子浓度间的关系有:5c(Cl-)═4c(HCO3-)+4c(CO32-)+4c(H2CO3) | |
| B. | 常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液中水的电离程度:③>①>② | |
| C. | 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:C(CH3COO-)>C(CH3COOH)>C(H+)>C(OH-) | |
| D. | 等体积等物质的量浓度的NaF溶液与NaCl溶液中离子总数:N(NaF)>N(NaCl) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com