
ЈЁ1Ј©УГБЈЧУ·ыәЕМоРҙПВБРҝХ°ЧЈЁБРҫЩіцИ«ІҝҝЙДЬөДЗйҝцЈ©
|
|
ўЩ |
ўЪ |
ўЫ |
ўЬ |
Ўӯ |
|
ІРБф№ММеіЙ·Ц |
|
|
|
|
|
|
ИЬТәЦРөДҪрКфАлЧУ |
|
|
|
|
|
ўЖөұИЬТәЦРҪрКфАлЧУЦ»УРFe2+әНCu2+КұЈ¬ФтbөДИЎЦө·¶О§КЗЎЎЎЎЎЎЎЎ ___ ЈЁУГaЎўxұнКҫЈ©ЎЈ
ўЗөұx=0.5КұЈ¬ИЬТәЦРFe2+УлFe3+өДОпЦКөДБҝПаөИКұЈ¬ФЪұкЧјЧҙҝцПВ№ІІъЙъ672 mLЖшМеЎЈЗуaЎўbөДЦөЎЈ
ўЕ
ўЖ ўЗa=0.04 molЈ¬b=0.12 mol
|
ЈЁ1Ј©
ўЖ3Cu + 8HNO3=3Cu(NO3)2+2NOЎь+4H2O ax 3Fe + 8HNO3 = 3Fe(NO3)2+2NOЎь+4H2O a(1-x)
ПыәДПхЛбЧЬБҝn(H
ўЗёщҫЭөзЧУКШәгөГЈә0.5aЎБ2+0.25aЎБ3+0.25aЎБ2= УЦЦӘЈә3Cu Ў« 8HNO3 3Fe Ў« 8HNO3 Fe Ў« 4HNO3(ЙъіЙFe3+) b=
|


 ЖЪД©ёҙП°јмІвПөБРҙр°ё
ЖЪД©ёҙП°јмІвПөБРҙр°ё і¬ДЬС§өдөҘФӘЖЪЦРЖЪД©ЧЁМвіеҙМ100·ЦПөБРҙр°ё
і¬ДЬС§өдөҘФӘЖЪЦРЖЪД©ЧЁМвіеҙМ100·ЦПөБРҙр°ё »ЖёФ360¶И¶ЁЦЖГЬҫнПөБРҙр°ё
»ЖёФ360¶И¶ЁЦЖГЬҫнПөБРҙр°ё Сф№вҝјіЎөҘФӘІвКФҫнПөБРҙр°ё
Сф№вҝјіЎөҘФӘІвКФҫнПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
| ўЩ | ўЪ | ўЫ | ўЬ | ўЭ | ўЮ | |
| ІРБф№ММеіЙ·Ц | FeЎўCu | Cu | Cu | - | - | - |
| ИЬТәЦРөДҪрКфАлЧУ |
| 8 |
| 3 |
| x |
| 3 |
| 8 |
| 3 |
| x |
| 3 |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
(1)УГБЈЧУ·ыәЕМоРҙПВБРҝХ°Ч(БРҫЩіцИ«ІҝҝЙДЬөДЗйҝц)
| ўЩ | ўЪ | ўЫ | ўЬ | Ўӯ |
ІРБф№ММеіЙ·Ц |
|
|
|
|
|
ИЬТәЦРөДҪрКфАлЧУ |
|
|
|
|
|
(2)өұИЬТәЦРҪрКфАлЧУЦ»УРFe2+әНCu2+КұЈ¬ФтbөДИЎЦө·¶О§КЗ__________________(УГaЎўxұнКҫ)ЎЈ
(3)өұx=0.5Ј¬ИЬТәЦРFe3+УлFe2+өДОпЦКөДБҝПаөИКұЈ¬ФЪұкЧјЧҙҝцПВ№ІІъЙъ672 mLЖшМеЎЈЗуaЎўbөДЦөЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
(1)ЛжHNO3УГБҝөДФцјУЈ¬ИЬТәЦРөДҪрКфАлЧУәНІРБф№ММеөДіЙ·ЦТАҙОУРБщЦЦЗйҝцЈ¬ЗлУГБЈЧУ·ыәЕМоРҙПВБРҝХ°ЧЈә
| ўЩ | ўЪ | ўЫ | ўЬ | ўЭ | ўЮ |
ИЬТәЦРөДҪрКфАлЧУ |
| Fe2+ |
| Fe2+ Cu2+ |
| Cu2+ Fe3+ |
ІРБф№ММеіЙ·Ц | Fe Cu |
| Cu | ЎӘ | ЎӘ | ЎӘ |
(2)өұИЬТәЦРҪрКфАлЧУЦ»УРFe2+ЎўCu2+КұЈ¬ЗуbөДИЎЦө·¶О§ЎЈ?
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә2015ҪмЙПәЈКРЖЦ¶«РВЗшёЯ¶юЙПС§ЖЪЖЪД©ҝјКФ»ҜС§КФҫнЈЁҪвОц°жЈ© МвРНЈәМоҝХМв
ПЦУРFeЎўCuЧйіЙөДәПҪрЈ¬ЖдЦРCuЎўFeөДЧЬОпЦКөДБҝОӘa molЈ¬CuөДОпЦКөДБҝ·ЦКэОӘxЈ»СРіЙ·ЫД©әуЈ¬И«ІҝН¶Илә¬b mol HNO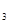 өДПЎИЬТәЦРЈ¬ОўИИК№Ждід·Ц·ҙУҰЈ¬ЗТПхЛбөД»№ФӯІъОпЦ»УРNOЈ¬КФ»ШҙрПВБРОКМвЈә
өДПЎИЬТәЦРЈ¬ОўИИК№Ждід·Ц·ҙУҰЈ¬ЗТПхЛбөД»№ФӯІъОпЦ»УРNOЈ¬КФ»ШҙрПВБРОКМвЈә
ЈЁ1Ј©ИфКЈУаөДІРФьЦ»УРCuЈ¬ФтИЬТәЦРә¬УРөДҪрКфАлЧУОӘ__________ЎЈ(РҙіцЛщУРҝЙДЬЗйҝц)
ЈЁ2Ј©өұИЬТәЦРҪрКфАлЧУЦ»УРFe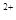 ЎўCu
ЎўCu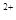 КұЈ¬ФтbөДИЎЦө·¶О§КЗ(УГaЎўxұнКҫ)___________ЎЈ
КұЈ¬ФтbөДИЎЦө·¶О§КЗ(УГaЎўxұнКҫ)___________ЎЈ
ЈЁ3Ј©өұxЈҪ0.5Ј¬ИЬТәЦРFe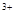 УлFe
УлFe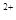 өДОпЦКөДБҝПаөИКұЈ¬ФЪұкЧјЧҙҝцПВ№ІІъЙъ672 mLЖшМеЎЈФтaЈҪ____________ЎўbЈҪ_____________ЎЈ
өДОпЦКөДБҝПаөИКұЈ¬ФЪұкЧјЧҙҝцПВ№ІІъЙъ672 mLЖшМеЎЈФтaЈҪ____________ЎўbЈҪ_____________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ПЦУРFeЎўCuЧйіЙөДәПҪрЈ¬ЖдЦРCuЎўFeөДЧЬОпЦКөДБҝОӘamolЈ¬CuөДОпЦКөДБҝ·ЦКэОӘxЈ»СРіЙ·ЫД©әуЈ¬И«ІҝН¶Илә¬bmol HNO3өДПЎИЬТәЦРЈ¬ОўИИК№Ждід·Ц·ҙУҰЈ¬ЗТПхЛбөД»№ФӯІъОпЦ»УРNOЈ¬КФ»ШҙрПВБРОКМвЈә(ТСЦӘЈәCu+2Fe3+=2Fe2++Cu2+)
ЈЁ1Ј©ЛжHNO3УГБҝөДФцјУЈ¬ИЬТәЦРөДҪрКфАлЧУәНІРБф№ММеөДіЙ·ЦТАҙОУРБщЦЦЗйҝцЈ¬ЗлУГБЈЧУ·ыәЕМоРҙПВБРҝХ°ЧЈә
| ўЩ | ўЪ | ўЫ | ўЬ | ўЭ | ўЮ |
ИЬТәЦРөДҪрКфАлЧУ |
| Fe2+ |
| Fe2+ЎўCu2+ |
| Cu2+ЎўFe3+ |
ІРБф№ММеіЙ·Ц | FeЎўCu |
| Cu | ЁDЁD | ЁDЁD | ЁDЁD |
ЈЁ2Ј©өұИЬТәЦРҪрКфАлЧУЦ»УРFe2+ЎўCu2+КұЈ¬ЗуbөДИЎЦө·¶О§ЎЈ
ЈЁ3Ј©өұx=0.5КұЈ¬ИЬТәЦРFe3+УлFe2+өДОпЦКөДБҝПаөИКұЈ¬ФЪұкЧјЧҙҝц№ІІъЙъ672mLЖшМеЎЈЗуaЎўbөДЦөЎЈ
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com