
【题目】砷(As)原子序数为33,可以形成As2S3、As2O5、H3ASO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)砷在周期表中的位置为第___周期___族。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。若反应生成6mol单质硫,则需要___molO2。该反应需要在加压下进行,原因是___。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3ASO4(s) △H1
H2(g)+2O2(g)=H3ASO4(s) △H1
H2(g)+![]() O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
2As(s)+![]() O2(g)=As2O5(s) △H3
O2(g)=As2O5(s) △H3
则反应2H3AsO4(s)=As2O5(s)+3H2O(l)的△H=___。
(4)298K时,将10mL3xmol·L-1Na3AsO3、10mL3xmol·L-1I2和10mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)=AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
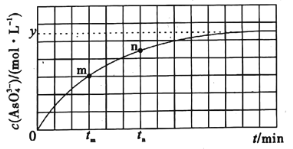
①下列可判断反应达到平衡的是___(填标号)。
a.v(OH-)=2v(AsO33-)
b.I2的浓度不再变化
c.![]() 不再变化
不再变化
d.c(I-)=ymol·L-1
②tm时,v正___v逆(填“大于”“小于”或“等于”)。
③图中m点和n点的逆反应速率较大的是___。
④若平衡时溶液的c(H+)=10-14mol/L,则该反应的平衡常数K为___。
【答案】四 ⅤA 5 提高氧气浓度,有效提高As2S3转化率 3△H2+△H3-2△H1 bc 大于 n 
【解析】
(1)砷是33号元素,有4个电子层,最外层有5个电子;
(2)As2S3生成H3AsO4和单质硫,1 molAs2S3生成3molS,化合价总升高10;增大压强可以提高氧气浓度;
(3)根据盖斯定律计算2H3AsO4(s)=As2O5(s)+3H2O(l)的焓变;
(4)①根据平衡标志分析;
②tm时刻后,c(AsO43-)增大;
③c(AsO43-)越大,逆反应速率越大;
④利用“三段式”计算平衡常数;
(1)砷是33号元素,有4个电子层,最外层有5个电子,所以砷在周期表的第四周期第ⅤA族;
(2)As2S3生成H3AsO4和单质硫,1molAs2S3生成3molS,化合价总升高10;若生成6molS需要2mol As2S3,转移20mol电子,根据得失电子守恒消耗5mol氧气;增大压强可以提高氧气浓度,有效提高As2S3转化率;
(3)已知:① As(s)+![]() H2(g)+2O2(g)=H3ASO4(s) △H1
H2(g)+2O2(g)=H3ASO4(s) △H1
② H2(g)+![]() O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
③ 2As(s)+![]() O2(g)=As2O5(s) △H3
O2(g)=As2O5(s) △H3
根据盖斯定律②×3+③-①×2得2H3AsO4(s)=As2O5(s)+3H2O(l) △H=3△H2+△H3-2△H1。
(4)①a.v(OH-)=2v(AsO33-),不能判断正逆反应速率是否相等,不一定平衡,故不选a;
b.化学平衡状态是各物质浓度不变的状态,I2的浓度不再变化,一定平衡,故选b;
c. OH-是反应物,AsO43-是生成物,![]() 不再变化,说明浓度不变,一定平衡,故不选c;
不再变化,说明浓度不变,一定平衡,故不选c;
d.根据图象可知,平衡时c(I-)=2c(AsO43-)=2 ymol·L-1, 所以c(I-)=ymol·L-1时,该反应一定不平衡,故不选d;选bc。
②tm时刻后,c(AsO43-)增大,反应正向进行,v正大于v逆;
③c(AsO43-)越大,逆反应速率越大;图中n点c(AsO43-)大于m点,所以逆反应速率较大的是n;
④将10mL3xmol·L-1Na3AsO3、10mL3xmol·L-1I2和10mLNaOH溶液混合,混合后c(AsO33-)、c(I2)均为xmol·L-1;


 。
。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgCl2固体。
A.①②③⑤B.③⑥C.③D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物中间体Q、医用材料PVA的合成路线如下。
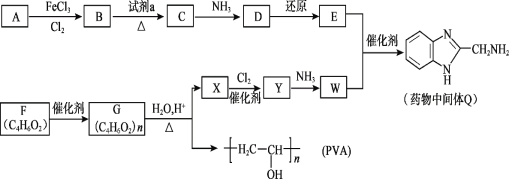
已知:![]()
(1)A的分子式是C6H6,A→B的反应类型是_______。
(2)B→C是硝化反应,试剂a是_______。
(3)C→D为取代反应,其化学方程式是_______。
(4)E的结构简式是_______。
(5)F含有的官能团是________。
(6)G→X的化学方程式是________。
(7)W能发生聚合反应,形成的高分子结构简式是________。
(8)将下列E +W→Q的流程图补充完整(在虚线框内写出物质的结构简式):__________________
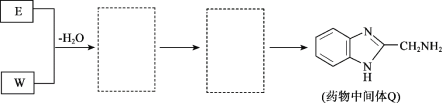
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是(已知Ksp(AgCl)=4.0×10-10,Ksp(AgBr)=4.9×10-13,Ksp(Ag2CrO4)=2.0×10-12)
A.0.lmol·L-1 NH4HS溶液中有:c(NH4+)+c(NH3·H2O)>c(HS-)+c(S2-)
B.将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,AgCl沉淀质量大于AgBr沉淀
C.向浓度均为1×10-3mol/L的KCl和K2CrO4混合液中滴加1×10-3mol/LAgNO3溶液,CrO42-先形成沉淀
D.常温下,pH=4.75、浓度均为0.l mol/L的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的离子方程式为___。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该反应的化学方程式___。配制FeCl3溶液和FeCl2溶液都应保持___(填“酸性”“碱性”或“中性”),原因是___。配制FeCl2溶液时还应加入少量铁屑,原因是___。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+I3- ②I3-+2S2O32-=3I-+S2O62-
反应①中的还原产物为___。现取10.00mL含Cu2+的溶液,加入足量KI充分反应后,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液12.50mL,此溶液中Cu2+的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纳米Fe/Ni复合材料能去除污染水体的NO3,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(NH4+无法占据活性位点)。反应过程如图所示:
(1)酸性环境中,纳米Fe/Ni去除NO3分两步,将步骤ii补充完整:
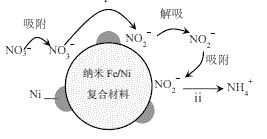
ⅰ.NO3+Fe+2H+=NO2+Fe2++H2O
ⅱ.□ +□ +□H+=□Fe2++□ +□ ______
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因_________。
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中随时间的变化如图1所示。(注:c0(NO3)为初始时NO3的浓度。)
①为达到最高去除率,应调水体的初始pH=______。
②t<15min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是_______。

(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,随时间的变化如图2所示。40min时总氮量较初始时下降,可能的原因是_____。
(5)利用电解无害化处理水体中的NO3,最终生成N2逸出。其装置及转化图如图所示:
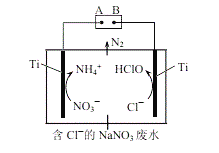
①阴极的电极反应式为___________。
②生成N2的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2![]() 在空气中存在下列平衡:2NO(g)+O2(g)
在空气中存在下列平衡:2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g)
2NO2(g) ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1。SO2通常在NO2的存在下,进一步被氧化生成SO3(g)。写出NO2和SO2反应生成NO(g)和SO3(g)的热化学方程式为________。
2SO3(g) ΔH=-196.6 kJ·mol-1。SO2通常在NO2的存在下,进一步被氧化生成SO3(g)。写出NO2和SO2反应生成NO(g)和SO3(g)的热化学方程式为________。
(2)提高2SO2(g)+O2(g)![]() 2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
①温度为T℃时,在2 L的密闭容器中加入2.0 mol ![]() 和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的
和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的![]() 。该反应的平衡常数为_____。
。该反应的平衡常数为_____。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_____。
A.在其他条件不变时,减少容器的体积
B.在其他条件不变时,改用高效催化剂
C.在其他条件不变时,升高体系温度
D.1.0mol温度和容器体积不变,充入1.0 mol氦气![]()
E.温度和容器体积不变,充入1.0 mol O2
(3)利用如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为______;若通入的NO体积为4.48 L(标况下),则理论上另一电极通入SO2的物质的量应为_______。
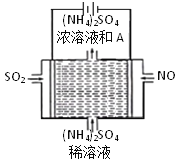
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2![]() 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③混合气体的平均相对分子质量不再改变的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
A.①③④ B.①④⑥ C.②③⑤ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新鲜水果、蔬菜、乳制品中富含的维生素C,具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下: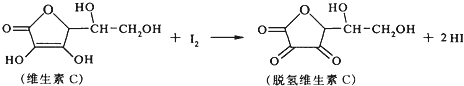
下列说法正确的是( )
A. 上述反应为取代反应
B. 维生素C不可溶于水,可溶于有机溶剂
C. 维生素C在酸性条件下水解只得到1种产物
D. 脱氢维生素C的分子式为C6H8O6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com