
ЁОЬтФПЁПдквЛЖЈЮТЖШЯТЃЌНЋ2mol AКЭ2mol BСНжжЦјЬхЛьКЯгк2LУмБеШнЦїжаЃЌЗЂЩњЗДгІ3A(g)+B(g)![]() 2C(g)+2D(g)ЃЌ2minФЉЗДгІДяЕНЦНКтзДЬЌЃЌЩњГЩ0.8 molDЁЃгЩДЫЭЦЖЯЃК
2C(g)+2D(g)ЃЌ2minФЉЗДгІДяЕНЦНКтзДЬЌЃЌЩњГЩ0.8 molDЁЃгЩДЫЭЦЖЯЃК
ЃЈ1ЃЉЩњГЩDЕФЗДгІЫйТЪ____________ЁЃ
ЃЈ2ЃЉBЕФЦНКтХЈЖШЮЊ________ЁЃ
ЃЈ3ЃЉAЕФзЊЛЏТЪЮЊ________ЁЃ
ЃЈ4ЃЉИУЮТЖШЯТЕФЦНКтГЃЪ§KЃН___ЁЃ
ЃЈ5ЃЉШчЙћдіДѓЗДгІЬхЯЕЕФбЙЧПЃЌдђЦНКтЬхЯЕжаCЕФзЊЛЏТЪ___ЁЃ(ЬюЁАдіДѓЁБЛђЁАМѕаЁЁБЛђЁАВЛБфЁБ)
ЁОД№АИЁП0.2molЁЄL-1ЁЄmin-1 0.8 molЁЄL-1 60% 0.5 ВЛБф
ЁОНтЮіЁП
ИљОнШ§ЖЮЪНЃК3A(g)+B(g)![]() 2C(g)+2D(g)
2C(g)+2D(g)
Ц№ЪМХЈЖШ(mol/L) 1 1 0 0
БфЛЏХЈЖШ(mol/L) 0.6 0.2 0.4 0.4
ЦНКтХЈЖШ(mol/L) 0.4 0.8 0.4 0.4
ЃЈ1ЃЉЩњГЩDЕФЗДгІЫйТЪЮЊ0.4mol/LЁТ2min=0.2molЁЄL-1ЁЄmin-1ЁЃ
ЃЈ2ЃЉBЕФЦНКтХЈЖШЮЊ0.8 molЁЄL-1ЁЃ
ЃЈ3ЃЉAЕФзЊЛЏТЪЮЊЃЈ0.6/1ЃЉЁС100%=60%ЁЃ
ЃЈ4ЃЉИУЮТЖШЯТЕФЦНКтГЃЪ§K=ЃЈ0.42ЁС0.42ЃЉ/(0.8ЁС0.43)=0.5ЁЃ
ЃЈ5ЃЉИУЗДгІЪЧЦјЬхЬхЛ§ВЛБфЕФПЩФцЗДгІЃЌШчЙћдіДѓЗДгІЬхЯЕЕФбЙЧПЃЌдђЦНКтЬхЯЕжаCЕФзЊЛЏТЪВЛБфЁЃ


 ЯАЬтОЋбЁЯЕСаД№АИ
ЯАЬтОЋбЁЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2A ![]() BЃЋCдкФГвЛЮТЖШЪБЃЌДяЕНЦНКтЁЃ
BЃЋCдкФГвЛЮТЖШЪБЃЌДяЕНЦНКтЁЃ
(1)ШєЮТЖШЩ§ИпЃЌЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌдђе§ЗДгІЪЧ________ЗДгІ(ЬюЁАЗХШШЁБЛђЁАЮќШШЁБ)ЃЛ
(2)ШєBЮЊЙЬЬхЃЌМѕаЁбЙЧПЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌдђAГЪ______ЬЌЃЛ
(3)ШєAЁЂBЁЂCОљЮЊЦјЬхЃЌМгШыДпЛЏМСЃЌЦНКт______вЦЖЏ(ЬюЁАе§ЯђЁБЁЂЁАФцЯђЁБЛђЁАВЛЁБ)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПБћЭщЕФЗжзгНсЙЙПЩМђаДГЩМќЯпЪННсЙЙЁФЃЌгаЛњЮяAЕФМќЯпЪННсЙЙЮЊ![]() ЃЌгаЛњЮяBгыЕШЮяжЪЕФСПЕФH2ЗЂЩњМгГЩЗДгІПЩЕУЕНгаЛњЮяAЁЃЯТСагаЙиЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ
ЃЌгаЛњЮяBгыЕШЮяжЪЕФСПЕФH2ЗЂЩњМгГЩЗДгІПЩЕУЕНгаЛњЮяAЁЃЯТСагаЙиЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ
A.гаЛњЮяAЕФвЛТШДњЮяжЛга4жж
B.гУЯЕЭГУќУћЗЈУќУћгаЛњЮяAЃЌУћГЦЮЊ2ЃЌ2ЃЌ3-Ш§МзЛљЮьЭщ
C.гаЛњЮяAЕФЗжзгЪНЮЊC8H18
D.BЕФНсЙЙПЩФмга3жжЃЌЦфжавЛжжЕФУћГЦЮЊ3ЃЌ4ЃЌ4-Ш§МзЛљ-2-ЮьЯЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯЪЛЈБЃЯЪМСS-геПЙЫижЦМСЃЌПЩБЃжЄЯЪЛЈЪЂПЊЁЃS-геПЙЫиЕФЗжзгНсЙЙШчЯТЭМЃЌЯТСаЙигкИУЮяжЪЕФЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ

A.ЦфЗжзгЪНЮЊC15H20O4
B.МШФмЗЂЩњМгГЩЗДгІЃЌгжФмЗЂЩњШЁДњЗДгІ
C.1molИУЮяжЪЭъШЋШМЩеЃЌашвЊЯћКФ403.2LбѕЦј
D.МШФмЪЙзЯЩЋЪЏШяЪдМСЯдКьЩЋЃЌгжФмЪЙЫсадKMnO4ШмвКЭЪЩЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉ1molЧтЦјдкТШЦјжаГфЗжШМЩеЩњГЩТШЛЏЧтЦјЬхЪБЗХГі184.6 kJЕФШШСПЃЌЪдаДГіЖдгІЕФШШЛЏбЇЗНГЬЪН___________________ЁЃБъзМзДПіЯТ11.2LЧтЦјдкТШЦјжаГфЗжШМЩеЗХГіЕФШШСПЪЧ______kJЁЃ
ЃЈ2ЃЉA(g)+B(g)![]() C(g)+D(g)Й§ГЬжаЕФФмСПЃЈkJЃЉБфЛЏШчЭМЫљЪОЃЌЛиД№ЯТСаЮЪЬтЁЃ
C(g)+D(g)Й§ГЬжаЕФФмСПЃЈkJЃЉБфЛЏШчЭМЫљЪОЃЌЛиД№ЯТСаЮЪЬтЁЃ

ЂйЗДгІЮяA(g)КЭB(g)ОпгаЕФзмФмСП_______ЃЈЬюДѓгкЁЂаЁгкЁЂЕШгкЃЉЩњГЩЮяC(g)КЭD(g)ОпгаЕФзмФмСПЁЃ
ЂкИУЗДгІЪЧ_______ЗДгІЃЈЬюЮќШШЁЂЗХШШЃЉЃЌЁїH=_____ЃЈгУE1КЭE2БэЪОЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏКЯЮяЕФжЊЪЖЙсДЉећИіИпжабЇЯАЃЌЭЈЙ§ЁЖЛЏбЇЗДгІдРэЁЗетБОЪщЕФбЇЯАИќЪЧМгЩюСЫЖдЫќУЧЕФШЯЪЖЁЃ
(1)бЧСзЫсЪЧЖўдЊШѕЫсЁЃвбжЊЃК
![]()
![]()
![]()
Чѓ![]()
![]()
![]() ______________
______________
(2)бЧСзЫсШмвКгыЯѕЫсвјШмвКЛьКЯЩњГЩЕЅжЪвјКЭNOЃЌаДГіИУЗДгІЕФРызгЗНГЬЪН_________
(3)Йигк![]() ШмвКЃЌЯТСаБэДяе§ШЗЕФЪЧ_____
ШмвКЃЌЯТСаБэДяе§ШЗЕФЪЧ_____
A.![]()
B.![]()
C.![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП500 mL KNO3КЭCu(NO3ЃЉ2ЕФЛьКЯШмвКжаc(NO![]() ЃЉЃН0.6 molЁЄLЃ1ЃЌгУЪЏФЋзїЕчМЋЕчНтДЫШмвКЃЌЕБЭЈЕчвЛЖЮЪБМфКѓЃЌСНМЋОљЪеМЏЕН2.24 LЦјЬх(БъзМзДПіЯТЃЉЃЌМйЖЈЕчНтКѓШмвКЬхЛ§ШдЮЊ500 mLЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
ЃЉЃН0.6 molЁЄLЃ1ЃЌгУЪЏФЋзїЕчМЋЕчНтДЫШмвКЃЌЕБЭЈЕчвЛЖЮЪБМфКѓЃЌСНМЋОљЪеМЏЕН2.24 LЦјЬх(БъзМзДПіЯТЃЉЃЌМйЖЈЕчНтКѓШмвКЬхЛ§ШдЮЊ500 mLЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A.дЛьКЯШмвКжаc(KЃЋЃЉЮЊ0.2 molЁЄLЃ1
B.ЩЯЪіЕчНтЙ§ГЬжаЙВзЊвЦ0.2 molЕчзг
C.ЕчНтЕУЕНЕФCuЕФЮяжЪЕФСПЮЊ0.05 mol
D.ЕчНтКѓШмвКжаc(HЃЋЃЉЮЊ0.2 molЁЄLЃ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2019ФъХЕБДЖћЛЏбЇНБЪкгшдМКВЁЄЙХЕЯФЩЗђЁЂЫЙЬЙРћЁЄЭўЭЂКККЭМЊвАеУЃЌБэеУЫћУЧЖдяЎРызгЕчГибаОПЕФЙБЯзЁЃСзЫсбЧЬњяЎЃЈLiFePO4ЃЉЕчГиЪЧаТФмдДЦћГЕЕФЖЏСІЕчГижЎвЛЁЃВЩгУЪЊЗЈвБН№ЙЄвеЛиЪеЗЯОЩСзЫсбЧЬњяЎЕчГие§МЋЦЌЃЈГ§LiFePO4ЭтЃЌЛЙКЌгаAlВЁЂЩйСПВЛШмгкЫсМюЕФЕМЕчМСЃЉжаЕФзЪдДЃЌВПЗжСїГЬШчЭМЃК
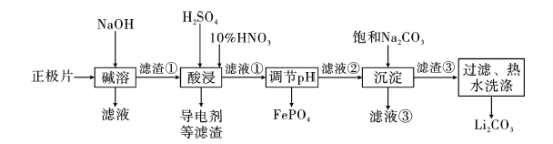
вбжЊЃКKSP ( Li2CO3)=2.0ЁС10-3 ЁЃВПЗжЮяжЪЕФШмНтЖШЃЈSЃЉШчЯТБэЫљЪОЃК
TЁц | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
20 | 1.33 | 34.2 | 0.039 |
80 | 0.85 | 30.5 | ЁЊЁЊ |
100 | 0.72 | ЁЊЁЊ |
ЃЈ1ЃЉ СїГЬжагУЁАШШЫЎЯДЕгЁБЕФдвђЪЧ____________ЁЃ
ЃЈ2ЃЉаДГіМюШмЪБAlВШмНтЕФЛЏбЇЗНГЬЪН ___________ЁЃ
ЃЈ3ЃЉЫсНўЪБЃЌгУH2O2ДњЬцHNO3ИќКУЃЌЦфгХЕуЪЧ________ЁЃ
ЃЈ4ЃЉСзЫсбЧЬњяЎЕчГидкЙЄзїЪБЃЌе§МЋЗЂЩњLiFePO4КЭFePO4ЕФзЊЛЏЃЌИУЕчГиЗХЕчЪБе§МЋЕФЕчМЋЗДгІЪНЮЊ____ЁЃ
ЃЈ5ЃЉШєТЫвКЂкжаc(Li+)=4mol/LЃЌМгШыЕШЬхЛ§ЕФNa2CO3ШмвККѓЃЌLi+ЕФГСНЕТЪДяЕН90%ЃЌМЦЫуТЫвКЂлжаc(CO32-)=____mol/L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПFe3O4ЪЧвЛжжКкЩЋЗлФЉЃЌгжГЦДХадбѕЛЏЬњЃЌЫќЕФзщГЩПЩаДГЩFeOЁЄFe2O3ЁЃФГЛЏбЇЪЕбщаЁзщЭЈЙ§ЪЕбщРДЬНОПвЛКкЩЋЗлФЉЪЧЗёгЩFe3O4ЁЂCuOзщГЩ(ВЛКЌгаЦфЫќКкЩЋЮяжЪ)ЁЃЬНОПЙ§ГЬШчЯТЃК
ЂёЃЎЬсГіМйЩшЃК МйЩш1ЃЎКкЩЋЗлФЉЪЧCuOЃЛМйЩш2ЃЎКкЩЋЗлФЉЪЧFe3O4;
МйЩш3ЃЎКкЩЋЗлЮДЪЧCuOКЭFe3O4ЕФЛьКЯЮя
ЂђЃЎЩшМЦЬНОПЪЕбщЃК
ЗНАИвЛЃКШЁЩйСПЗлФЉМгШызуСПЯЁЯѕЫсЃЌШєМйЩш2ЛђМйЩш3ГЩСЂдђЪЕбщЯжЯѓЪЧ___________ЃЌЯрЙиЗДгІЕФРызгЗНГЬЪНЮЊ__________________________________ЁЃ
ЗНАИЖўЃК ВщдФзЪСЯЃК Cu2+гызуСПАБЫЎЗДгІЩњГЩЩюРЖЩЋШмвКЃЌCu2++4NH3ЁЄH2O=Cu(NH3)42++4H2OЁЃЮЊЬНОПЪЧМйЩш2ЛЙЪЧМйЩш3ГЩСЂЃЌСэШЁЩйСПЗлФЉМгЯЁСђЫсГфЗжШмНтКѓЃЌдйМгШызуСПАБЫЎЃЌШєВњЩњ___________ЯжЯѓЃЌдђМйЩш2ГЩСЂЃЛШєВњЩњ___________ЯжЯѓЃЌдђМйЩш3ГЩСЂЁЃ
ЗНАИШ§ЃК
бЇЩњБћРћгУЯТЭМЫљЪОзАжУНјааЪЕбщЃЌГЦСПЗДгІЧАКѓзАжУCжабљЦЗЕФжЪСПЃЌвдШЗЖЈбљЦЗЕФзщГЩЁЃЛиД№ЯТСаЮЪЬтЃК

(1)ЯТСаЪЕбщВНжшЕФЯШКѓЫГађЪЧ___________(ЬюађКХ)ЁЃ
ЂйДђПЊжЙЫЎМаЃЛЂкЙиБежЙЫЎМаЃЛЂлЕуШМCДІЕФОЦОЋХчЕЦЃЛ
ЂмЯЈУ№CДІЕФОЦОЋХчЕЦ ЂнЪеМЏЧтЦјВЂбщДПЁЃ
дкЕуШМCДІОЦОЋХчЕЦЧАвЊНјааЕФБивЊВйзїЪЧ__________________________ЁЃ
(2)МйЩшбљЦЗШЋВПВЮМгЗДгІЃЌШєЪЕбщЧАбљЦЗЕФжЪСПЮЊ4.7ПЫЃЌЪЕбщКѓГЦЕУзАжУCжаЙЬЬхЕФжЪСП3.6ПЫдђМйЩш___________(ЬюЁА1ЁБЁА2ЁБЛђЁА3ЁБ) е§ШЗЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com