
【题目】下列有关说法中不正确的是
A. 某溫度时的混合溶液中C(H+) =![]() mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数)
B. 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的PH可能为2或12
C. 已知Ksp(AgCl)=1.56×10-10。Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,Cl-先产生沉淀
D. 常温下PH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)
【答案】D
【解析】A、某溫度时的混合溶液中C(H+) =![]() mol·L-1,而KW= c(H+) c(OH-),说明c(H+)= c(OH-),则溶液一定为中性,选项A正确;B、常温下,KW= c(H+) c(OH-)=10-14,纯水中c(H+)=c(OH-)=10-7,某溶液中,由水电离出的c(H+)=10-12mol·L-1<10-7 mol·L-1,说明溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,则该溶液可能是酸或碱或强酸的酸式盐,如果为酸溶液,则PH=2,如果为碱溶液,则pH=12,选项B正确;C、已知Ksp(AgCl)=1.56×10-10、Ksp(Ag2CrO4)=9.0×10-12,析出沉淀时,AgCl溶液中c(Ag+)=
mol·L-1,而KW= c(H+) c(OH-),说明c(H+)= c(OH-),则溶液一定为中性,选项A正确;B、常温下,KW= c(H+) c(OH-)=10-14,纯水中c(H+)=c(OH-)=10-7,某溶液中,由水电离出的c(H+)=10-12mol·L-1<10-7 mol·L-1,说明溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,则该溶液可能是酸或碱或强酸的酸式盐,如果为酸溶液,则PH=2,如果为碱溶液,则pH=12,选项B正确;C、已知Ksp(AgCl)=1.56×10-10、Ksp(Ag2CrO4)=9.0×10-12,析出沉淀时,AgCl溶液中c(Ag+)=![]() =
=![]() =1.56×10-8mol/L,Ag2CrO4溶液中:c(Ag+)=
=1.56×10-8mol/L,Ag2CrO4溶液中:c(Ag+)=![]() =
=![]() mol/L=3×10-5mol/L>1.56×10-8mol/L,Cl-先产生沉淀,选项C正确;D、常温下PH=7的CH3COOH和CH3COONa混合溶液呈中性,则c(H+)= c(OH-),结合电荷守恒可知:c(Na+)= c(CH3COO-),选项D不正确。答案选D。
mol/L=3×10-5mol/L>1.56×10-8mol/L,Cl-先产生沉淀,选项C正确;D、常温下PH=7的CH3COOH和CH3COONa混合溶液呈中性,则c(H+)= c(OH-),结合电荷守恒可知:c(Na+)= c(CH3COO-),选项D不正确。答案选D。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)已知:4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。


(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
①平衡时,甲容器中CO的转化率是____________。比较下列容器中CO的转化率:乙________甲;丙________甲(填“>”、“=”或“<”)。
②丙容器中,通过改变温度,使CO的平衡转化率增大,则温度____________(填“升高”或“降低”),平衡常数K__________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。下列说法不正确的是

A. H2CO3、HCO3-、CO32-不能在同一溶液中大量共存
B. H2CO3电离平衡常数Ka1≈10-6
C. pH=7时,溶液中存在关系c(HCO![]() )>c(H2CO3)>c(CO
)>c(H2CO3)>c(CO![]() )
)
D. pH=9时,溶液中存在关系c(H+)+c(H2CO3)=c(OH-)+c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂。某课题组经查阅资料后设计合成铝氢化钠的流程如图所示。

已知:①AlCl3、NaH、NaAlH4遇水都能迅速发生反应。
②常温下,可用高锰酸钾、氯酸钾、重铬酸钾、次氯酸钙等与浓盐酸反应制取氯气。
(1)铝氢化钠遇水发生剧烈反应,甚至可能发生爆炸,其原因是_______
写出铝氢化钠与水反应的化学方程式_________
(2)甲同学设计实验制备无水氯化铝的装置如图所示。
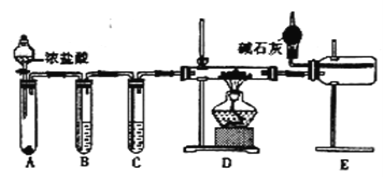
①装置E中干燥管的作用是_______________________。
②点燃装置D处酒精灯之前 需先排尽装置内的空气,其操作方法是______。
(3)乙同学分析甲同学设计的装置后,认为只改变A、B、D中的试剂就可以用甲同学设计的装置制备NaH。
①试管B中的试剂改为____________________。
②若操作不当,则制得的NaH产品中可能含有的杂质有_______。
(4)丙同学设计以下3种装置测定铝氢化钠样品的纯度(假设杂质不参与反应)。
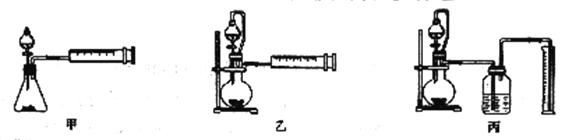
从易操作性、准确性角度考虑宜选装置___。如何判断铝氢化钠与水完全反应:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在探索、开发的新能源有:( )
①核能 ②柴草 ③煤炭 ④太阳能 ⑤氢能 ⑥液化石油气 ⑦水煤气 ⑧天然气
A.①④⑤B.②③⑥⑦C.③⑥⑦⑧D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应的化学方程式为aFeCl2+bKNO3+ cHCl=d FeCl3+eKCl+f X+gH2O。若b=1,d=3,X为生成物,其分子式应为 ( )
A. NH4Cl B. NO2 C. NO D. N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子数目的对应关系,完全正确的是( )
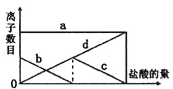
A. a:K+; b:HCO3—;c:CO32—;d:Cl—
B. a:K+; b:CO32—;c:HCO3—;d:Cl—
C. a:K+; b:CO32—;c:Cl—;d:HCO3—
D. a:K+; b:HCO3—;c:Cl—;d:CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是
A. 酸性氧化物:CO2、SiO2、SO2、NO2
B. 碱:烧碱、纯碱、苛性钾、氢氧化钡
C. 混合物:盐酸、漂白粉、水煤气、氢氧化铁胶体
D. 碱性氧化物:Na2O、CaO、MgO、Al2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com