
| A. | 原子半径 | B. | 简单离子的还原性 | ||
| C. | 单质的熔沸点 | D. | 氢化物的稳定性 |
分析 原子序数随着卤素原子核电荷数的增加,原子半径增大,状态由气态变为液态到固态,电子层数逐渐增大,非金属性逐渐减弱,单质的氧化性逐渐减弱,形成的气态氢化物的稳定性逐渐降低,最高价含氧酸的酸性逐渐降低,形成阴离子的还原性增强.
解答 解:A、原子序数随着卤素原子核电荷数的增加,原子半径增大,故A错误;
B、第VIIA族元素,随着卤素原子核电荷数的增加,电子层数逐渐增大,非金属性逐渐减弱,单质的氧化性逐渐减弱,形成阴离子还原性增强,故B错误.
C、第VIIA族元素,从上到下,状态由气态变为液态到固态,熔沸点逐渐升高,故C错误;
D、第VIIA族元素,随着卤素原子核电荷数的增加,电子层数逐渐增大,非金属性逐渐减弱,形成的气态氢化物的稳定性逐渐降低,故D正确;
故选D.
点评 本题考查同一主族元素性质递变规律,为高考高频点,熟练掌握碱金属族、卤族元素及第三周期元素原子结构及其性质递变规律,注意规律中的特殊现象,题目难度不大.


科目:高中化学 来源: 题型:推断题
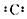 B-的结构示意图
B-的结构示意图 C+的电子式Na+
C+的电子式Na+查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “碘遇淀粉变蓝色”,“碘”指碘元素 | |
| B. | 为了补碘,要多食用含高碘酸的食物 | |
| C. | 碘水中加入CCl4后,充分混合后静置分层.CCl4在下层,呈现紫红色.如果在太空实验室中混合这两种液体,CCl4就未必在下层 | |
| D. | 通过“取样→灼烧→溶解→过滤→萃取”可从海带中提取单质碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应是吸热反应 | |
| B. | 化学反应中的能量变化只表现为热量变化 | |
| C. | 当反应物的总能量高于生成物的总能量时,通常发生放热反应 | |
| D. | 当反应物的总能量高于生成物的总能量时,通常发生吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取某盐溶液进行焰色反应,火焰呈黄色,说明该盐溶液含钠元素,一定不含钾元素 | |
| B. | 用小刀切下一小块金属钠,将剩余的钠再放回原试剂瓶 | |
| C. | 向某溶液中加入BaCl2溶液产生白色沉淀,再加稀盐酸沉淀不溶解,说明原溶液中一定含有SO42- | |
| D. | 向沸水中逐滴滴加1mol•L-1FeCl3溶液,并不断用玻璃棒搅拌,可制得Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com