

分析 (1)实验室常用碳酸钙与稀盐酸反应制取二氧化碳,制取气体的装置能“随开随用,随关随停”,是利用的启普发生器原理分析选择装置,制得的二氧化碳中含有氯化氢和水蒸气,利用装置B除氯化氢,利用装置C除水蒸气;
(2)①装置F中无明显现象,证明没有CO生成,装置D中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,其中一种固体为碳酸钠,另一种固体为C;
②装置D中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置F中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应产物为碳酸钠和CO.
解答 解:(1)实验室常用碳酸钙与稀盐酸反应制取二氧化碳,反应方程式为:CaCO3+2H+=Ca2++H2O+CO2↑;制取气体的装置能“随开随用,随关随停”,是利用的启普发生器原理分析选择装置;制得的二氧化碳中含有氯化氢和水蒸气,利用装置B饱和NaHCO3除氯化氢,利用装置C浓H2SO4除水蒸气;
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;Ⅲ;饱和NaHCO3;浓H2SO4;
(2)①装置F中无明显现象,证明没有CO生成,装置D中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,
其中一种固体为碳酸钠,另一种固体为C,反应的方程式为4Na+3CO2$\frac{\underline{\;高温\;}}{\;}$2Na2CO3+C;
故答案为:4Na+3CO2$\frac{\underline{\;高温\;}}{\;}$2Na2CO3+C;
②由题意可知,装置D中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,
装置F中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应产物为碳酸钠和CO,反应的化学方程式为2Na+2CO2$\frac{\underline{\;高温\;}}{\;}$Na2CO3+CO;
故答案为:2Na+2CO2$\frac{\underline{\;高温\;}}{\;}$Na2CO3+CO.
点评 本题考查性质实验方案的设计,涉及实验装置的选择,物质性质的实验设计验证分析应用,主要是钠及其化合物性质的判断理解,掌握基础是关键,题目难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).
某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的3mol/L H2SO4,振荡溶解,过滤后将滤液配成250mL溶液,待用. | |
| 步骤2 | 取少量步骤1中滤液于试管中,滴加1~2滴20%KSCN | 溶液变红色,则固体产物含+3价铁 |
| 步骤3 | 取少量步骤1中滤液于试管中,滴加1~2滴0.01mol/L KMnO4 | 溶液紫色褪去,则固体产物含+2价铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
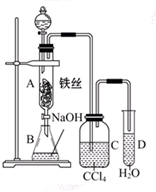 某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可发生反应生 成溴苯和溴化氢,此反应为 放热反应.他们用如图所示 装置制取溴苯.已知:溴蒸气为红棕色
某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可发生反应生 成溴苯和溴化氢,此反应为 放热反应.他们用如图所示 装置制取溴苯.已知:溴蒸气为红棕色 ,观察到A中的现象反应混合液微沸,有红棕色气体充满A容器.实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,写出有关反应的化学方程式Br2+2NaOH═NaBr+NaBrO+H2O.
,观察到A中的现象反应混合液微沸,有红棕色气体充满A容器.实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,写出有关反应的化学方程式Br2+2NaOH═NaBr+NaBrO+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾、漂白粉都可以用于净水,但净水原理不相同 | |
| B. | 游离态氮转化为化合态氮,只有在高温、高压和催化剂的作用下才能实现 | |
| C. | 制造光缆和计算机芯片的主要材料都含有硅元素 | |
| D. | 农业上使用高效低毒的农药,可降低蔬菜的农药残留 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com