
| A. | 工业合成氨中,将氨气液化分离以提高氨气产率 | |
| B. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 两支试管中分别加入等体积5%的H3O2溶液,在其中一支试管中加入2~3滴FeCl3溶液,该试管中产生气泡快 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A、将氨气液化分离,平衡向正反应方向移动,提高氨气产率,符合勒夏特列原理,故A正确;
B、汽水瓶中存在平衡H2CO3?H2O+CO2,打开汽水瓶时,压强降低,平衡向生成二氧化碳方向移动,可以用勒夏特列原理解释,故B正确;
C、氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2O?ClO-+2H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,所以可以勒夏特列原理解释,故C正确;
D、铁离子对过氧化氢的分解起催化作用,而催化剂只改变反应速率,不影响平衡的移动,所以不符合勒夏特列原理,故D错误;
故选D.
点评 本题考查勒夏特列原理知识,题目难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且是否发生平衡的移动.


科目:高中化学 来源: 题型:解答题
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
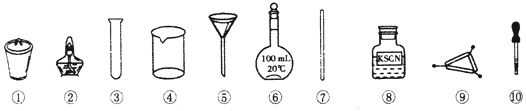
| A. | 将茶叶灼烧灰化,选用②、④和⑨ | |
| B. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④和⑦ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的Fe3+,选用③、⑧和⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
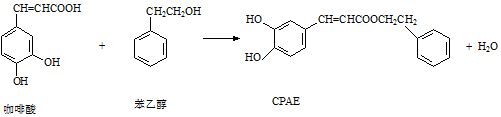
| A. | 苯乙醇属于芳香醇,它与邻甲基苯酚互为同系物 | |
| B. | 1 mol CPAE最多可与含3 mol NaOH的溶液发生反应 | |
| C. | 不能用FeCl3溶液可以检测上述反应中是否有CPAE生成 | |
| D. | 咖啡酸、苯乙醇及CPAE都能发生取代、加成和消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物质能的缺点是严重污染环境 | |
| B. | 生物质能源是可再生的能源 | |
| C. | 利用生物质能就是间接利用太阳能 | |
| D. | 使用沼气这种生物质能是对化学能的充分利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | 反应温度/℃ | Na2S2O3浓液/mL | 甲 | 0.1mol/LH2SO4溶液/mL | 乙 |
| ① | 25℃ | 10.0 | 0 | 10.0 | |
| ② | 25℃ | 5.0 | a | 10.0 | |
| ③ | 45℃ | 10.0 | 0 | 10.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和时所需NaOH的量 | B. | 与Mg反应的起始速率 | ||
| C. | OH-的物质的量浓度 | D. | 溶液中$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 |
| A | 加热放在坩埚中的小钠块 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
| C | 在含有酚酞的水中加入一小块钠 | 钠浮在水面上,四处游动,发出嘶嘶响声,溶液变红 |
| D | 在空气中久置的铝条放入稀硫酸溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com