
 ,故答案为:
,故答案为: ;
;| 11.2L |
| 22.4L/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、ClO-、Na+、H+、Cl- |
| B、Mg2+、Cu2+、Cl-、SO42- |
| C、Na+、Ba2+、Cl-、CO32- |
| D、K+、H+、Fe2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
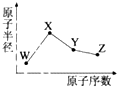 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )| A、对应简单离子半径X<W |
| B、对应气态氢化物的稳定性Y<Z |
| C、化合物XZW既含离子键也含共价键 |
| D、Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
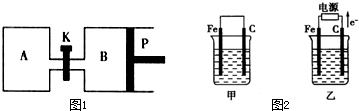
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO的初始浓度(mol/L) | 2 | 4 | 1 | 3 |
| H2的初始浓度(mol/L) | 3 | 2 | 3 | 3 |
| 时间(min) | 8 | 6 | 12 | n |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、滴定盐酸的pH变化曲线为图2 |
| B、在滴定CH3COOH溶液的过程中,始终都有c(Na+)+c(H+)═c(CH3COO-)+c(OH-) |
| C、滴定CH3COOH溶液的过程中,当滴加12.5mL NaOH溶液时,溶液中离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、当c(Na+)═c(CH3COO-)+c(CH3COOH)时,溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使甲基橙变红的溶液中:CO32-、Ba2+、Cl-、Na+ |
| B、在c(H+)=1×10-12的溶液中:AlO2-、CO32-、Na+、K+ |
| C、由水电离产生的c(OH-)=1×10-10mol/L的溶液中:NO3-、Mg2+、SO42-、Fe2+ |
| D、无色透明溶液中:Al3+、HCO3-、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
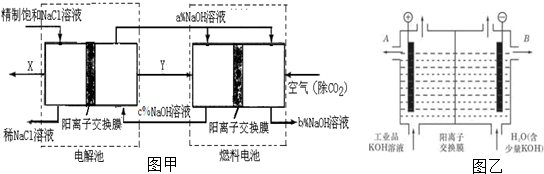
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com