
【题目】由工业级碳酸锂(含有少量碳酸镁等杂质)制备高纯碳酸锂。实验过程如下:

(1)实验室中在下图所示装置中进行碳化反应:

①碳化反应的主要反应离子方程式为 。
②碳化时温度需控制在30℃,可采取的措施是 。
温度不宜过高的原因是 。
(2)用CO2调pH为8—9,其目的是 。
(3)已知在不同温度下蒸发分解碳酸锂的产率与溶解度关系如图:

90℃以下,随温度升高,碳酸锂产率升高的原因可能是 。
(4)请补充完整由滤液制备高纯碳酸锂的实验方案:取滤液放置于烧杯中 。
【答案】
(1)①CO2+Li2CO3+H2O===2Li++2![]() (3分)
(3分)
②给三颈烧瓶水浴加热(2分) 温度高碳酸氢锂分解和二氧化碳溶解度降低(3分)
(2)使少量的碳酸锂和氢氧化锂转化为碳酸氢锂,减少损失(2分)
(3)温度高碳酸氢锂分解完全,碳酸锂溶解度小(2分)
(4)在90℃下蒸发至出现大量晶体,趁热过滤,热水洗涤2~3次,干燥 (3分)
【解析】
试题分析:
(1)碳化过程是二氧化碳与碳酸锂反应,CO2+Li2CO3+H2O===2Li++2![]() ;控制低于100℃的恒温可以采用水浴加热的方法;温度过高会使一些稳定性差的物质分解如碳酸氢锂,同时会减小气体的溶解度,导致溶解气体的量偏小;
;控制低于100℃的恒温可以采用水浴加热的方法;温度过高会使一些稳定性差的物质分解如碳酸氢锂,同时会减小气体的溶解度,导致溶解气体的量偏小;
(2)用CO2调pH为8—9,若pH过低会导致氢氧化镁溶解,过高会使得更多的锂以碳酸锂的形式存在,转化率减小。调节pH的目的是使少量的碳酸锂和氢氧化锂转化为碳酸氢锂,减少损失;
(3)温度高有利于碳酸氢锂的分解,同时从图像可以看出,温度高碳酸锂的溶解度低,析出的碳酸锂更多;
(4)流程中有环节蒸发分解,即蒸发浓缩的过程中碳酸氢锂分解,因为碳酸锂溶解度随温度升高而降低,所以温度高有利于碳酸锂析出,热水洗涤,干燥即可用获得产品。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.油脂有油和脂肪之分,但都属于酯
B.糖类、油脂、蛋白质都是高分子化合物
C.糖类、油脂、蛋白质都能发生水解
D.葡萄糖与淀粉互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,使一定量的A和B气体混合发生2A(g)+3B(g)![]() 4C(g)反应。下列描述中,说明反应已达到平衡状态的是
4C(g)反应。下列描述中,说明反应已达到平衡状态的是
A. 各物质的浓度之比c(A)∶c(B)∶c(C)=2∶3∶4
B. 混合气体中各物质的浓度相等
C. 单位时间内,若消耗了a molA物质,同时也消耗了2a mol C物质
D. 混合气体的体积是反应开始前的4/5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质反应后一定有+3价铁生成的是( )
①少量 Fe在Cl2燃烧;② Fe与过量稀H2SO4反应;③ FeCl2溶液中加入氢氧化钠溶液;④ FeO和Fe2O3的混合物溶于盐酸中。
A. ① ② ④ B. ① ③ ④ C. ① ② ③ D. ② ③ ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A中含有三种元素,3.68gA在氧气中充分锻烧后生成1.28g B、1.60g C和气体D。物质A~H存在如下转化关系。已知B是一种红色固体单质,C是金属氧化物,D是非金属氧化物,E、F、G是盐。

请回答:
(1)检验气体D的实验方法:____________________。
(2)写出B与H浓溶液反应的化学方程式:____________________。
(3)化合物A的化学式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是合成新农药的重要中间体。以化合物A为原料合成化合物G的工艺流程如下:

(1)化合物G中含氧官能团的名称为 。
(2)反应E→F的类型为 。
(3)化合物B的分子式为C7H6Cl2,B的结构简式为 。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式: 。
①能发生银镜反应;
②能水解,且水解产物之一能与FeCl3溶液发生显色反应;
③分子中只有3种不同化学环境的氢。
(5)请以化合物F和CH2(COOC2H5)2为原料制备 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) 。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品安全和化学科学密切相关,下列说法不正确的是
A. 可用聚乙烯制作食品包装袋
B. 瘦肉精可提高生猪的瘦肉量,我们应向养猪厂家大力推广
C. 食用过量发色剂(主要成分为NaNO2)会引起人体中毒
D. 绿色食品的生产须以生态环境较佳的地域为基地,并采用绿色生产技术和工艺
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:用CO(g)还原NO2(g)的能量转化关系如图所示。
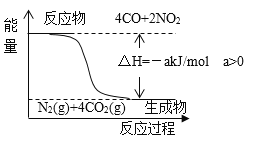
若用标准状况下22.4LCO,还原NO2至N2(CO完全反应)的整个过程中,转移电子的物质的量为_______mol,放出的热量为_______kJ(用含有a的代数式表示)。
(2)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1molCH4还原NO2至N2和液态水,整个过程中放出的热量为867kJ,则△H2=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com