
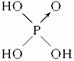
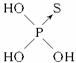
不能与这两种农药混合使用的物质是( )
A.KCl B.NaOH C.NaNO3 D.Na2SO4
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
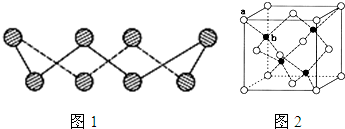
| SO | 2- 3 |
| ||
| (540.0×10-10cm)3 |
| ||
| (540.0×10-10cm)3 |
| 270.0 | ||
|
135.0×
| ||
sin
|
| 3 |
| 270.0 | ||
|
135.0×
| ||
sin
|
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
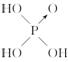
不能与这两种农药混合使用的物质是
A.KCl B.NaOH C.NaNO3 D.Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com