
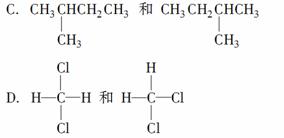
下列各组有机物的结构表达式中互为同分异构体的是( )。
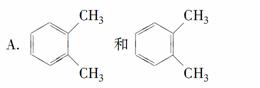
B. 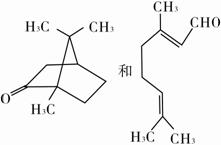
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
下列四种元素中,其单质氧化性最强的是( )
A.原子含有未成对电子最多的第二周期元素 B.位于周期表中第三周期ⅢA族的元素
C.原子最外层电子排布为2s22p4的元素 D.原子最外层电子排布为3s23p3的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
用Pt作电极,电解100 mL 0.4 mol·L-1的NaCl溶液和100 mL 0.1 mol·L-1的稀硫酸,标准状况下产生0.224 L Cl2时停止电解,取出电极,将两烧杯溶液混合并冷却至常温,所得溶液的pH为(设气体产物全部逸出,混合溶液的总体积为200 mL)( )
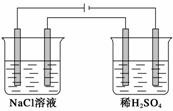
A.5 B.6 C.7 D.13
查看答案和解析>>
科目:高中化学 来源: 题型:
冶炼铜矿石所获得的铜通常含有锌、铁、镍、银、金和铂等微量杂质,俗称粗铜。工业上通常通过电解法除去这些杂质制得精铜,以提高铜的使用价值,扩大铜的应用范围。(几种金属的相对原子质量是:Fe-56,Ni-59,Cu-64,Zn-65,Ag-108,Au-197。)
请完成下列问题:
(1)一般来说,电解精炼铜的初始电解质溶液里的阳离子是__________,写出铜的电解精炼过程中的阴极反应式________________________________。
(2)如果转移0.020 mol e-,下列说法中一定正确的是________。
①阴极质量增加0.64 g ②阳极质量减少0.64 g
③电解质溶液的质量保持不变 ④电解质溶液的温度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
苹果酸的结构简式为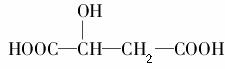 ,下列说法正确的是( )。
,下列说法正确的是( )。
A.苹果酸中能发生酯化反应的官能团有2种
B.1 mol苹果酸可与3 mol NaOH发生中和反应
C.1 mol苹果酸与足量金属Na反应生成1 mol H2
D.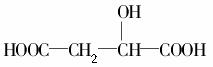 与苹果酸互为同分异构体
与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
向200 mL稀硝酸溶液中加入11.2 g铁粉,充分反应后,铁粉全部溶解并放出NO气体,溶液质量增加7.0 g,则所得溶液中Fe3+的物质的量浓度约为
( )。
A.0.1 mol/L B.0.2 mol/L
C.0.3 mo/L D.0.4 mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组将一定质量的镁铝合金材料投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n(mol)与加入NaOH溶液的体积V(mL)的关系如图所示。
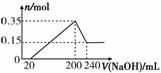
请回答下列问题:
(1)该合金材料中,镁、铝的物质的量之比为______。
(2)硫酸的物质的量浓度为______。
(3)另取相同质量的该合金材料与7.8 g Na2O2一起投入足量的H2O中,最终产生的气体在标准状况下的体积为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碰撞理论,分子在发生反应时必须要进行有效碰撞。那些具有足够高能量,能发生有效碰撞的分子称为活化分子,要使普通分子成为活化分子所需最小能量称为活化能(Ea)。一定温度下气体分子中的活化分子百分数是一定的,而催化剂可以改变活化能的大小。如图表示298.15 K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图,据图回答:
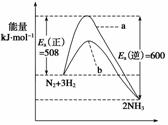
(1)若反应中生成2 mol氨,则反应________(填“吸热”或“放热”)________kJ。
(2)在图中曲线________(填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理是_____________________________________________________________
________________________________________________________________________。
(3)目前合成氨工业广泛采用的反应条件500℃、20 MPa~50 MPa、铁触媒,反应转化率不超过50%,工业上为了进一步提高氨气产率,你认为下列措施最经济可行的是
________________________________________________________________________。
A.降低反应温度,让反应向着有利于氨气生成的方向进行
B.升高温度,让更多的分子变成活化分子
C.寻求能在更低的温度下有很强催化活性的新型催化剂
D.寻求新型耐高压材料,将压强增大一倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com