
在反应3Cl2+8NH3→6NH4Cl+N2中,设阿伏加德罗常数为NA.则下列说法正确的是()
A. 若有0.3 mol Cl2参加反应,转移的电子数为0.6NA
B. 若生成2.24 L氮气,转移的电子数为0.6NA
C. 若有1.2NA个电子发生转移,则被氧化的氨气的质量是27.2 g
D. 若生成1 mol的氯化铵转移电子数是n个,则NA=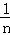
考点: 阿伏加德罗常数.
专题: 阿伏加德罗常数和阿伏加德罗定律.
分析: A、分析化学反应中元素化合价变化,升高的做还原剂,元素化合价降低的做氧化剂,依据电子守恒计算得到;
B、分析化学反应中元素化合价变化,升高的做还原剂,元素化合价降低的做氧化剂,依据电子守恒计算得到;
C、依据电子守恒计算,被氧化的氨气是氮元素化合价发生变化的氨气;
D、若生成1 mol的氯化铵转移电子数是1mol为n个;
解答: 解:A、反应3Cl2+8NH3→6NH4Cl+N2中,3Cl2~6Cl﹣~6e﹣,2NH3~N2~6e﹣,所以0.3 mol Cl2参加反应,转移的电子数为0.6NA,故A正确;
B、反应3Cl2+8NH3→6NH4Cl+N2中,3Cl2~6Cl﹣~6e﹣,2NH3~N2~6e﹣,生成1mol氮气主要电子6mol,生成2.24 L氮气物质的量不一定是0.1mol,转移的电子数不一定为0.6NA,故B错误;
C、反应3Cl2+8NH3→6NH4Cl+N2中,3Cl2~6Cl﹣~6e﹣,2NH3~N2~6e﹣,转移6mol电子,被氧化的氨气为2mol,有1.2NA个电子发生转移,则被氧化的氨气物质的量为0.4mol,被氧化的氨气的质量=0.4mol×17g/mol=6.8 g
,故C错误;
D、依据反应的电子转移守恒可知,生成6mol氯化铵时电子转移6mol,生成1mol氯化铵转移电子1mol,若生成1 mol的氯化铵转移电子数是n个,则NA=n,故D错误;
故选A.
点评: 本题考查了阿伏伽德罗常数应用,主要是氧化还原反应电子转移计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是()
A. Na2SO4 B. H2SO4 C. AgNO3 D. NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. H、D、T属于同位素,H2、D2、T2属于同素异形体
B. 氯水、氨水、王水是混合物,水银、水玻璃是纯净物
C. HCl、NH3、BaSO4是电解质,CO2、Cl2、CH3CH2OH是非电解质
D. 水能、风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法在一定条件下可以实现的是()
①酸性氧化物与碱反应
②弱酸与盐溶液反应可生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液呈中性
⑤有单质参加的非氧化还原反应
⑥两种含氧化合物反应的产物有气体.
A. ①②③④⑤⑥ B. ②④⑤⑥ C. ①②③⑤ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32﹣、SO32﹣、SO42﹣、C1﹣中的若干种,现取X溶液进行连续实验,实验过程及产物如图.下列说法正确的是()
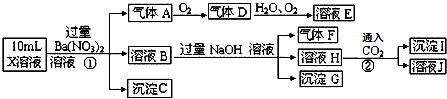
A. 气体A是NO2
B. X中肯定存在Fe2+、A13+、NH4+、SO42﹣
C. 溶液E和气体F不能发生化学反应
D. X中不能确定的离子是 A13+和C1﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l、+2.已知Cu2O与稀硫酸反应,溶液呈蓝色.现向Cu、Cu2O和CuO组成的混合物中,加入1L 0.6mol/L HNO3溶液恰好使混合物溶解,同时收集到2240mL NO气体(标准状况).请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 .
(3)若混合物中含0.1mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 .
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做()
A. 阴极 B. 阳极 C. 正极 D. 负极
查看答案和解析>>
科目:高中化学 来源: 题型:
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)═2C(g),反应2min的时间,并测得该段时间内C的反应速率为0.6mol•L﹣1•min﹣1,现有下列几种说法中正确的是()
①用物质A表示的反应的平均速率为0.6mol•L﹣1•s﹣1
②用物质B表示的反应的平均速率为0.05mol•L﹣1•s﹣1
③2min时容器中A的物质的量为2.8mol
④2min时物质B的浓度为0.4mol•L﹣1.
A. ①③ B. ②④ C. ②③ D. ④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com