
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示。下列有关说法正确的是

A. 实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
B. 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
C. 沉淀乙一定有BaCO3,可能有BaSO4
D. 一定没有Fe3+,但是无法确定是否含有I-
【答案】B
【解析】pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L;由于pH=1的某溶液中H+浓度为0.1mol/L,则说明溶液中无CO32-;向溶液中加入过量的(NH4)2CO3溶液,生成的无色气体甲为CO2,生成的白色沉淀甲是CO32-和溶液中的弱碱阳离子双水解生成的,由于生成的沉淀为白色,故此弱碱阳离子为Al3+,还能说明溶液中不含Fe3+、Fe2+;向溶液中加入过量的Ba(OH)2溶液,生成的气体乙为NH3,由于前面加入的过量的(NH4)2CO3溶液能引入NH4+,故不能确定原溶液中含NH4+;前面加入的过量的(NH4)2CO3溶液能引入CO32-,故生成的白色沉淀乙一定含BaCO3;向溶液乙中加铜和硫酸,有遇空气变红棕色的气体丙生成,说明溶液中含NO3-.由于溶液显酸性,即含硝酸,则I-不能有;综上分析可知,溶液中一定无CO32-、Fe3+、Fe2+、I-,一定含0.1mol/LH+、0.1mol/LAl3+、0、1mol/LNO3-,由于溶液必须显电中性,且除H+外只能含4种离子,故溶液中一定含Cl-、SO42-;即溶液中一定无NH4+、K+、Na+、CO32-、Fe3+、Fe2+、I-,一定含Cl-、SO42-、H+、Al3+、NO3-;A.实验消耗Cu14.4g即0.225mol,设生成的气体丙NO的物质的量为xmol,根据得失电子数守恒可知:0.225mol×2=xmol×3,解得x=0.15mol,则0.15molNO与氧气反应后生成的气体丁NO2也为0.15mol,但由于状态不明确,故NO2的体积不一定是3.36L,故A错误;B.该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子,故B正确;C.由于原溶液中含SO42-,故沉淀乙一定有BaCO3,也一定含BaSO4,故C错误;D.溶液中一定不含I-,故D错误;故答案为B。


科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7是一种受热易分解的盐,下列各组对(NH4)2Cr2O7受热分解产物的判断可能正确的是
A. CrO3 + NH3 + H2 B. Cr2O3 + NH3 + H2O
C. CrO3 + N2 + H2O D. Cr2O3 + N2 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“玉兔”号月球车用 ![]() Pu作为热源材料.下列关于
Pu作为热源材料.下列关于 ![]() Pu的说法正确的是( )
Pu的说法正确的是( )
A.![]() Pu与
Pu与 ![]() U互为同位素
U互为同位素
B.![]() Pu与
Pu与 ![]() Pu互为同素异形体
Pu互为同素异形体
C.![]() Pu与
Pu与 ![]() U具有完全相同的化学性质
U具有完全相同的化学性质
D.![]() Pu与
Pu与 ![]() Pu具有相同的最外层电子数
Pu具有相同的最外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:①焰色反应属于化学性质 ②酸性氧化物都是非金属氧化物③FeCl2、Fe(OH)3、Fe3O4都能通过化合反应来制取 ④Na2O2不是碱性氧化物( )
A. ②③④B. ③④C. ①③④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用胶体知识解释的是( )
A. 静电除尘
B. 一支钢笔用不同牌子的两种墨水,易堵塞
C. 氯化铁溶液加入氢氧化钠溶液出现红褐色沉淀
D. 河水和海水交界处形成三角洲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况)
B.转移电子的物质的量为1.25 mol
C.有0.250 mol KNO3被氧化
D.被氧化的N原子的物质的量为3.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法,不正确的是 ( )
A.人体缺碘,可通过食用加碘盐补碘B.缺铁性贫血,可通过食用铁强化酱油预防
C.为了防止龋齿,人人都要使用含氟牙膏D.锌摄入量过多,也会引起缺铁性贫血
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了实现“将全球温度上升幅度控制在2℃以内”的目标,科学家正在研究温室气体CO2的转化和利用。
(1)海洋是地球上碳元素的最大“吸收池”
①溶于海水中的CO2主要以四种无机碳形式存在,分别为CO2、H2CO3、CO32-和_________(填离子符号)。
②在海洋中,可通过如图所示的途径来固碳。则发生光合作用时,CO2与H2O反应生成(CH2O)x和O2的化学方程式为__________________。

(2)有科学家提出可利用FeO来吸收CO2,已知:
C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
3FeO(s)+H2O(g)![]() Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
则6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s) △H=_____kJ·mol-1。
2Fe3O4(s)+C(s) △H=_____kJ·mol-1。
(3)以CO2为原料可制备甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
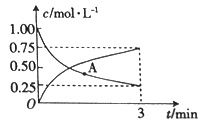
①若A点的正反应速率用v正(CO2)来表示,A点的逆反应速率用v逆(CO2)来表示,则v正(CO2)_______(填“>”“ <”或“=”)v逆(CO2)。
②0~3min内,氢气的平均反应速率v(H2)_______________。
(4)在一定条件下,二氧化碳转化为甲烷:CO2(g)+4H2(g)![]() CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K= ________。若200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K= ________。若200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com