
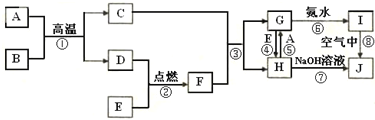
分析 (1)反应前后各元素化合价不变的化学反应是非氧化还原反应;
(2)反应前后双氧水中的元素得电子化合价降低,则双氧水体现氧化性;
(3)反应前后双氧水中的元素失电子化合价升高,则双氧水体现还原性;
(4)同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性.
解答 解:(1)反应前后各元素化合价不变的化学反应是非氧化还原反应,A中各元素在反应前后没有化合价的变化,所以是非氧化还原反应,B、C、D、E、F各步反应都涉及元素化合价的变化,都是氧化还原反应,故答案为:B、C、D、E、F;
(2)D、E、F中过氧化氢中的氧元素化合价降低,得电子发生还原反应,只具有氧化性,故答案为:D、E、F;
(3)C反应中过氧化氢中的氧元素化合价升高,失电子发生氧化反应,只具有还原性,故答案为:C;
(4)反应Ag2O+H2O2=2Ag+O2↑+H2O中,氧化银做氧化剂,双氧水作还原剂,则氧化性Ag2O>H2O2,反应H2O2+MnSO4=MnO2+H2SO4中,双氧水做氧化剂,MnO2做氧化产物,则氧化性H2O2>MnO2,故氧化性顺序为:Ag2O>H2O2>MnO2,故答案为:Ag2O>H2O2>MnO2.
点评 本题考查了氧化还原反应的有关知识,根据反应前后元素化合价的变化判断其氧化性、还原性即可,难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 从1L1mol•L-1的NaCl溶液中取出10mL,其浓度仍为1mol•L-1 | |
| B. | 配制0.5L1mol•L-1的盐酸,需要氯化氢气体11.2L(标准状况) | |
| C. | 将40gNaOH溶于1L水中,所得溶液的物质的量浓度为1mol/L | |
| D. | 0.5L2mol•L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改进汽车尾气净化技术,减少大气污染物的排放 | |
| B. | 开发利用可再生能源,减少化石燃料的使用 | |
| C. | 研发可降解高分子材料,减少“白色污染冶 | |
| D. | 过度开采矿物资源,促进地方经济发展 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的说法中正确的是( )
的说法中正确的是( )| A. | 所有碳原子都在同一平面上 | |
| B. | 最多只可能有9个碳原子在同一平面上 | |
| C. | 只可能有5个碳原子在同一直线上 | |
| D. | 可能有6个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 悬浊液的分散质可用过滤的方法从分散剂中分离出来 | |
| B. | 分散质粒子直径为1-100纳米的分散系是胶体 | |
| C. | 相同温度下同一种溶质的饱和溶液要比不饱和溶液的浓度大一些 | |
| D. | 任何物质在水中溶解都有一定的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水能导电,所以氯气是电解质 | |
| B. | CaCO3不溶于水,所以它是非电解质 | |
| C. | NaHCO3是强电解质,所以它的水溶液中不存在电离平衡 | |
| D. | 体积相同,c(OH-)相同的氨水和 NaOH 溶液被中和,前者消耗 HCl 多,所以NH3•H2O 是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
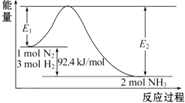 工业合成氨反应的能量变化如图所示.
工业合成氨反应的能量变化如图所示.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都有一定的限度,只是不同反应的限度不同罢了 | |
| B. | 化学反应的限度可通过改变条件而改变,如浓度、温度 | |
| C. | 可逆反应是指同一条件下,既可以向正反应方向进行,又可向逆反应方向进行的反应 | |
| D. | 当一个可逆反应进行到正反应速率与逆反应速率相等时,反应就停止了 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com