
| A. | 常温时不能发生的过程都是非自发过程 | |
| B. | 体系的无序性越高,即混乱度越高,熵值就越大 | |
| C. | 所有自发进行的化学反应都是放热反应 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
分析 利用△H-T△S>0时反应不能自发进行,△H-T△S<0时反应自发进行分析,其中S表示的是物质的混乱度;注意反应条件与反应能否自发进行没有必然关系,据此进行解答.
解答 解:A.自发与否由焓变与熵变共同决定,△H-T△S<0时反应自发进行,能够自发进行的反应在常温下一定发生,如氢气的燃烧,故A错误;
B.在同一条件下不同物质有不同的熵值,体系的无序性越高,其混乱度越大,熵值越大,故B正确;
C.自发与否由焓变与熵变共同决定,所以自发进行的化学反应不一定为放热反应,故C错误;
D.熵值表示混乱度的大小,混乱度越大,熵值越大,同一物质的固态、液态、气态混乱度依次增大,故D错误;
故选B.
点评 本题考查了反应热与焓变的应用,题目难度中等,明确反应能否自发进行的判断方法为解答关键,AC为易错点,注意反应条件与能否自发进行没有必然关系,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 58.5g NaCl含有NA个分子 | |
| B. | 1mol N2和3mol H2充分反应,有6NA电子转移 | |
| C. | 标准状况下,22.4LCHCl3含有分子数为NA | |
| D. | 46g NO2和N2O4混合气体含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(g.cm-3) | 水溶性 | |
| 苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
| 甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
| 苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
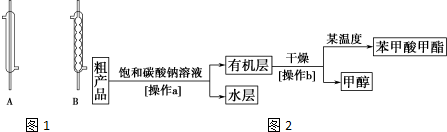
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (a、b、c均大于零) 下列说法不正确的是( )
(a、b、c均大于零) 下列说法不正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开 1 mol H-H 键和1 mol I-I键所需能量大于断开 2 mol H-I键所需能量 | |
| C. | 断开 2 mol H-I键所需能量约为(c+b+a) kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于 2a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量的变化,伴有能量变化的物质变化都是化学变化 | |
| B. | 101kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,H2(g)的燃烧热为285.8kJ•mol-1 | |
| C. | 在相同条件下的稀溶液中,1molHCl、1molHNO3分别与足量NaOH充分反应,放出的热量相等 | |
| D. | H2+Cl2═2HCl的能量变化情况可用如图表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高硫酸亚铁的溶解度 | B. | 防止硫酸亚铁分解 | ||
| C. | 抑制硫酸亚铁水解 | D. | 稀硫酸防止硫酸亚铁被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电子从3s能级跃迁到3p能级形成的光谱是发射光谱 | |
| B. | 白磷(P4)分子是正四面体结构,故分子中的键角为109°28′ | |
| C. | NO2- 中心原子采取sp2杂化,分子空间构型为“V”形 | |
| D. | 原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
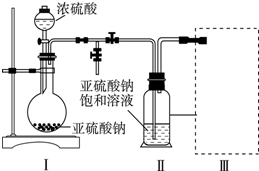
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com